今日は,2族元素に関する正誤問題です。
周期表の2族に属する元素には,ベリリウムBe,マグネシウムMg,カルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaがあります。
2族元素のうち,Be,MgとCa,Sr,Ba,Raは,多くの点で性質が異なるため,Ca,Sr,Ba,Raをアルカリ土類金属元素とよびBe,Mgと区別しています。
★★★2族元素を学習する上でのポイント★★★
2族の原子は2個の最外殻電子をもち,2個の電子を放出して2価の陽イオンになりやすいという特性があります。
アルカリ土類金属の単体は,いずれも銀白色の光沢をもち,アルカリ金属と比べると,融点は高く,密度も大きくなります。
これは,2個の価電子をもっているため,アルカリ金属よりも自由電子が多く,金属結合が強くなるためです。
また,単体はアルカリ金属同様に天然には存在せず,塩化物などの融解塩電解によって得られます。
☆それでは,問題に挑戦してみてください。
■Q1
BeとMgは常温の水と反応しないが,Ca,Sr,Baは常温の水と反応する。
■Q2
2族元素は,いずれも炎色反応を示す。
■Q3
酸化カルシウムは,炭酸カルシウムを焼くことによって得られる。
■Q4
酸化カルシウムは,水とも酸とも反応する。
■Q5
酸化カルシウムにコークスCを混ぜて電気炉で強熱すると,アセチレンが生成する。
■Q6
酸化カルシウムに濃いアンモニア水溶液をしみこませてから焼いて粒状にしたものをソーダ石灰という。
■Q7
BeとMgの水酸化物は水に溶けるが,Ca,Sr,Baの水酸化物は水に溶けない。
■Q8
水酸化カルシウムは,消石灰ともよばれ,その飽和水溶液は石灰水とよばれる。
■Q9
水酸化カルシウムを空気中に放置すると分解して,酸化カルシウムになる。
■Q10
水酸化カルシウムの水溶液に二酸化炭素を吹き込むと,白色沈殿を生じるが,さらに吹き込み続けると,沈殿が溶解する。
■Q11
水酸化カルシウムは塩素を吸収し,塩化カルシウムになる。
■Q12
炭酸カルシウムは水に溶けにくいが,酸には水素を発生して溶ける。
■Q13
炭酸水素カルシウムを加熱すると,分解して酸化カルシウムCaOが生成し,二酸化炭素が発生する。
■Q14
セッコウCaSO4・2H2Oを焼くと焼きセッコウとなり,これに水を加えて練ると,硬化して再びセッコウになる。
■Q15
硫酸カルシウムと硫酸バリウムは水に溶解するが,硫酸マグネシウムは水に溶解しない。
■Q16
ホタル石に濃硫酸を加えて加熱すると,フッ化水素が発生する。
■Q17
塩化カルシウムの固体は,酸性の乾燥剤として利用される。
以下は,解答と解説です。
□A1→ ○
☆解説
アルカリ土類金属であるカルシウムCa,ストロンチウムSr,バリウムBaは,アルカリ金属と同様に,常温の水と反応し,水素H2を発生して水酸化物になります。
ベリリウムBeとマグネシウムMgは,常温の水とは反応しませんが,マグネシウムのみ熱水とは反応します。
例1:カルシウムと水との反応
Ca + 2H2O → Ca(OH)2 + H2
例2:マグネシウムと熱水との反応
Mg + 2H2O → Mg(OH)2 + H2
☆Point !
アルカリ金属・アルカリ土類金属の単体は常温の水と反応して水素を発生して水酸化物になる。
Image may be NSFW.
Clik here to view.
□A2→ ×
☆解説
アルカリ土類金属のCa,Sr,Baは,炎色反応を示しますが,BeとMgは示しません。
炎色反応を示すものは,アルカリ金属とアルカリ土類金属と銅と覚えましょう。
Image may be NSFW.
Clik here to view.
□A3→ ○
☆解説
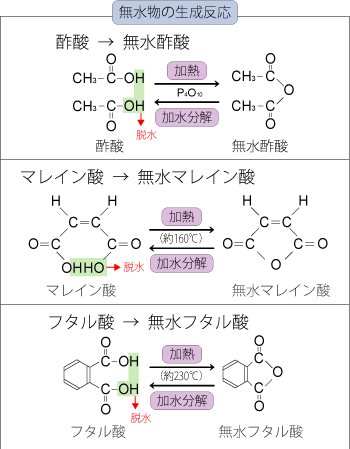
酸化カルシウムCaOは生石灰ともよばれ,白色の固体で,炭酸カルシウムCaCO3(白色)を900℃以上で焼くことによって得られます。
この反応は,アンモニアソーダ法の副反応でもあります。
CaCO3 → CaO + CO2
Image may be NSFW.
Clik here to view.
□A4→ ○
☆解説
アルカリ土類金属の酸化物は,アルカリ金属同様に塩基性酸化物で,水に溶けて強い塩基性を示したり,酸と反応して塩を生じます。
したがって,酸化カルシウムは,水と反応して水酸化物の水酸化カルシウムCa(OH)2になり,その水溶液は強い塩基性を示します。
CaO + H2O → Ca(OH)2
この反応では,多量の熱を発するため,酸化カルシウムは缶入りの酒や駅弁を温める発熱剤として,また吸湿性があり乾燥剤にも利用されています。
アンモニアソーダ法の副反応でもありますね。
一方,酸化カルシウムが塩酸と反応すると,塩化カルシウムCaCl2と水が生成します。
CaO + 2HCl → CaCl2 + H2O
□A5→ ×
☆解説
アセチレンC2H2ではなく,次のように,炭化カルシウムCaC2(カルシウムカーバイドまたはカーバイドともよばれる)が生成します。
CaO + 3C → CaC2 + CO
アセチレンは,次のように炭化カルシウムに水を加えることで得られます。
この反応では,同時に水酸化カルシウムが生成することも重要なので一緒におさえてください。
CaC2 + 2H2O → Ca(OH)2 + C2H2
□A6→ ×
☆解説
アンモニアNH3水溶液ではなく,水酸化ナトリウムNaOH水溶液です。
ソーダ石灰は,乾燥剤や二酸化炭素の吸収剤として用いられます。
また,酸化カルシウム自体でも吸湿性を示すため,乾燥剤として用いられます。
☆酸化カルシウムの反応と性質
① 白色の固体で生石灰とよばれる。
② 炭酸カルシウムCaCO3を焼くと生成。
③ 水と反応して水酸化カルシウムCa(OH)2となる際に,多量の熱を
発することから発熱剤となる。
④ 酸と反応する。
⑤ コークスCを作用させると炭化カルシウムCaC2が生成。
⑥ 乾燥剤となる。(ソーダ石灰はCO2も吸収。)
□A7→ ×
☆解説
水酸化ベリリウムBe(OH)2,水酸化マグネシウムMg(OH)2は水に溶けにくく,水酸化カルシウムCa(OH)2は少し溶け,水酸化ストロンチウムSr(OH)2,水酸化バリウムBa(OH)2はよく溶けます。
また,アルカリ金属,アルカリ土類金属の水酸化物は強塩基性となります。
(例:NaOH,KOH,Ca(OH)2など。)
☆Point !
アルカリ金属,アルカリ土類金属の水酸化物は強塩基性となる!
□A8→ ○
☆解説
水酸化カルシウムCa(OH)2は消石灰,その飽和水溶液は石灰水とよばれます。
また,漆喰(水酸化カルシウムを主成分とした建材)などの建築材料や,酸性土壌の改良剤として用いられています。
□A9→ ×
☆解説
水酸化カルシウムを放置ではなく加熱することで分解して,酸化カルシウムCaOになります。
Ca(OH)2 → CaO + H2O
これは,文字通り水酸化物から水がとれて酸化物になる反応で,アルカリ金属以外の多くの水酸化物に共通します。
□A10→ ○
☆解説
Ca(OH)2水溶液に二酸化炭素を吹き込むと,炭酸塩である炭酸カルシウムCaCO3が白色沈殿します。
Ca(OH)2 + CO2 → CaCO3 + H2O ……①
炭酸カルシウムに,さらに二酸化炭素を吹き込み続けると炭酸カルシウムの沈殿が溶解します。
CaCO3 + H2O + CO2 ⇔ Ca(HCO3)2 ……②
この水溶液を加熱すると,②式の逆反応が起こり,再び,炭酸カルシウムが白色沈殿します。漆喰は水酸化カルシウムが空気中の二酸化炭素を吸収して,炭酸カルシウムとなって固まる性質(①の反応)を利用しています。
また,①・②式の反応が起こってできる地形を鍾乳洞といいます。
☆鍾乳洞が作られる反応
石灰岩CaCO3からなる地層に二酸化炭素が溶け込んだ地下水がしみわたってくると,次の反応が起こり,炭酸カルシウムが溶け,鍾乳洞(洞窟)が作られます。
CaCO3 + H2O + CO2 → Ca(HCO3)2 ←鍾乳洞が作られる(穴があく)反応
また,鍾乳洞内では,Ca(HCO3)2を含んだ水が,石灰岩の割れ目から流れ落ち,ゆっくり滴り落ちる際に空気中へ水分が蒸発すると同時に二酸化炭素も放出するので,上式の逆反応が起こり,炭酸カルシウムが析出します。
析出した炭酸カルシウムのうち,鍾乳洞の天井からつららのように伸びたものを鍾乳石(しょうにゅうせき),地面から筍(たけのこ)のように伸びたものを石筍(せきじゅん)といいます。
Ca(HCO3)2 → CaCO3 + H2O + CO2
Image may be NSFW.
Clik here to view.
鍾乳洞が作られる反応は,よく出題されるので確実におさえましょう。
□A11→ ×
☆解説
次のように塩化カルシウムCaCl2ではなく,さらし粉CaCl(ClO)・H2Oが生成します。
Ca(OH)2 + Cl2 → CaCl(ClO)・H2O
さらし粉は水に溶かすと,次のように電離して酸化力の強い次亜塩素酸イオンClO-を生じるので,酸化剤,殺菌剤,漂白剤として広く用いられています。
Ca(OH)2の反応・性質についてまとめました。
☆Ca(OH)2の反応と性質
① 消石灰ともよばれ,その飽和水溶液は石灰水とよばれる。
② 水に少し溶け,その水溶液は強塩基性を示す。
③ 加熱すると分解して,酸化カルシウムCaOになる。
④ 二酸化炭素CO2を吸収させると,炭酸カルシウムCaCO3の沈殿が
生じ,さらにCO2を吸収させると沈殿が溶解する。
⑤ 塩素Cl2を吸収して,さらし粉CaCl(ClO)・H2Oが生成。
水酸化ナトリウムと水酸化カルシウムの性質と反応はくらべてまとめて覚えましょう。
Image may be NSFW.
Clik here to view.
□A12→ ×
☆解説
炭酸カルシウムCaCO3は水に溶けにくく,塩酸などの酸には水素ではなく,二酸化炭素を発生して溶けます。このため,酸との反応は二酸化炭素の実験室での製法としても用いられます。
ただし,塩酸のかわりに希硫酸を用いるのは,CaCO3のまわりを水に不溶の硫酸カルシウムCaSO4(白色)が覆ってしまい,反応が滞ってしまうため適当ではありません。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCO3は,石灰石,大理石,卵の殻,貝殻,真珠,珊瑚の主成分であり,セメントやガラスの原料,歯磨き粉やチョークなどに利用されています。
□A13→ ×
☆解説
加熱すると分解して,酸化カルシウムCaOが生成するのは,炭酸水素カルシウムCa(HCO3)2ではなく,炭酸カルシウムCaCO3です。
CaCO3 → CaO + CO2
これは,アンモニアソーダ法の副反応でもありますね。
一方,Ca(HCO3)2の水溶液を加熱すると,炭酸カルシウムCaCO3が生成し,二酸化炭素が発生します。
Ca(HCO3)2 → CaCO3 + H2O + CO2
☆Ca(HCO3)2は水溶液中にのみ存在し,固体として取り出すことはできません。
Na・Caの化合物の熱分解についてまとめました。
くらべてまとめて覚えましょう!
Image may be NSFW.
Clik here to view.
CaCO3の性質・反応は,アルカリ金属の代表であるNaの炭酸塩Na2CO3ともくらべてまとめて覚えましょう。
Image may be NSFW.
Clik here to view.
□A14→ ○
☆解説
硫酸カルシウム二水和物CaSO4・2H2Oはセッコウとよばれ,約120℃~140℃まで加熱すると水和水の一部がとれて,焼きセッコウCaSO4・1/2H2Oとなります。
また,焼きセッコウに水を加えて練ると発熱しながら硬化し,再びセッコウにもどります。
硫酸カルシウムCaSO4(白色)は,天然には硫酸カルシウム二水和物CaSO4・2H2Oとして産出し,上記の性質から,建築材料や塑像,医療用ギプスなどに用いられます。
□A15→ ×
☆解説
逆で,硫酸カルシウムCaSO4と硫酸バリウムBaSO4(白色)は水に溶解しませんが,硫酸マグネシウムMgSO4は溶解します。
硫酸バリウムは白色顔料やX線撮影の造影剤(安定で胃液によっても溶解せず,X線をよく遮蔽することから)として用いられています。
※「バリウムを飲む」と言われますが,バリウムBaは冷水と反応して,水素を発生するので飲むと危険です。実際に,病院で飲むのはバリウムではなくて硫酸バリウムです!
☆入試によく出るX線関連の物質
鉛Pb …… X線の遮蔽剤
硫酸バリウムBaSO4 …… X線の造影剤
ここで,アルカリ土類金属のCa,Sr,BaとBe,Mgとの相違点についてまとめました。
よく狙われるのでしっかりおさえてください。
① Ca,Sr,Baは,炎色反応を示すが,Be,Mgは,示さない。
② Ca,Sr,Baは,常温の水と反応する(水酸化物になる。)が, Be,Mgは,反応しない。(Mgは,熱水とは反応する。)
③ Ca,Sr,Baの水酸化物は,水に溶ける(その水溶液は強塩基性)が, Be,Mgの水酸化物は,水に溶けにくい。
④ Ca,Sr,Baの硫酸塩は,水に溶けにくいが,Be,Mgの硫酸塩は,水によく溶ける。
□A16→ ○
☆解説
ホタル石CaF2に濃硫酸を加えて加熱すると,硫酸塩を生じ,フッ化水素HFが発生します。
CaF2 + H2SO4 → CaSO2 + 2HF
□A17→ ×
☆解説
塩化カルシウムCaCl2の固体は,強酸と強塩基からなる塩なので中性です。
吸湿性,潮解性があり,中性の乾燥剤として利用されます。
カルシウムの反応系統図についてまとめました。
どの反応も重要なのでしっかり覚えましょう。
Image may be NSFW.
Clik here to view.
現在,HP『恋する数学』,『恋する化学』でチャートの割引きサービスを実施しております。
この機会に是非お買い求めください。
2族元素に関する正誤問題
14族元素に関する正誤問題
今日は,14族元素に関する正誤問題です。
周期表の14族に属する元素には,炭素C,ケイ素Si,ゲルマニウムGe,スズSn,鉛Pbがあります。これらはすべて典型元素ですがC,Siは非金属元素,Ge,Sn,Pbは金属元素に分類されます。
CとSiは,4個の価電子を持ち,イオンにはならずに他の原子とは共有結合によって化合物を作ります。
★★★14族元素を学習する上でのポイント★★★
① 炭素の同素体(特にダイヤモンドと黒鉛)の構造と性質に関する問題は頻出なので2つを比較しておさえる。
② ダイヤモンドとケイ素,一酸化炭素と二酸化炭素,二酸化炭素と二酸化ケイ素 の共通点・相違点をそれぞれ比較しておさえる。
③ 「二酸化ケイ素」→「ケイ酸ナトリウム」→「水ガラス」 →「ケイ酸」→ 「シリカゲル」の反応の流れをおさえる。
ここで,結晶の見分け方について解説します。
結晶とは物質を構成する粒子(原子・分子・イオン)が規則正しく配列した固体のことで,結晶には金属結晶,イオン結晶,分子結晶,共有結合の結晶の4種類があります。
結晶の見分け方は,結晶を構成する原子の組み合わせによって次のように判断します。
Image may be NSFW.
Clik here to view.
「分子を形成するかしないか」つまり「分子結晶か共有結合結晶か」の判断は,ダイヤモンドC,ケイ素Si,二酸化ケイ素SiO2,炭化ケイ素SiCの4つ以外は「分子を形成する」つまり『分子結晶』!と覚えるといいでしょう。
☆それでは,正誤問題に挑戦してみてください。
■Q1
天然の炭素原子には,質量数が12,13,14の3種類が存在し,このような原子を互いに同素体という。○or×
■Q2
ダイヤモンドと黒鉛は,いずれも共有結合の結晶で融点が非常に高く,電気伝導性がある。○or×
■Q3
フラーレン,カーボンナノチューブ,無定形炭素は,いずれも炭素の同素体である。○or×
■Q4
ケイ素は岩石や鉱物の成分として地殻中に酸素,アルミニウムに次いで多量に存在する。○or×
■Q5
単体のケイ素は,二酸化ケイ素を電気炉で融解し,コークスを用いて還元することによって得られる。○or×
■Q6
ケイ素はダイヤモンドと同じ構造をもち,硬くて融点が高い。○or×
■Q7
一酸化炭素は,加熱したコークスに酸素を反応させると得られる。○or×
■Q8
二酸化炭素は,石灰石や大理石に希塩酸を加えたり,強熱することで得られる。○or×
■Q9
一酸化炭素と二酸化炭素は,いずれも水に溶け弱酸性を示す。○or×
■Q10
一酸化炭素と二酸化炭素は,いずれも無色,無臭であるが,一酸化炭素は有毒で,二酸化炭素は無毒である。○or×
■Q11
一酸化炭素と二酸化炭素は,いずれも還元性をもつ。○or×
■Q12
液体の二酸化炭素は,ドライアイスとよばれている。○or×
■Q13
一酸化炭素を空気中で点火すると,青色の炎をあげて燃焼し二酸化炭素になる。○or×
■Q14
石灰水に二酸化炭素を通じると白く濁る。○or×
■Q15
二酸化ケイ素は,ダイヤモンドと同じ正四面体の構造をもつ。 ○or×
■Q16
二酸化ケイ素は,塩酸などの強酸に溶けてヘキサフルオロケイ酸となる。○or×
■Q17
二酸化ケイ素は,酸性酸化物で水とも塩基とも反応して塩を生成する。○or×
■Q18
ケイ酸ナトリウムに水を加えて,加熱して溶かしたものを水ガラスという。○or×
■Q19
水ガラスに塩酸を加えると,白色ゲル状のケイ酸が得られる。○or×
■Q20
ケイ酸を加熱脱水して固体にしたものをシリカという。○or×
■Q21
石英ガラスは,ケイ砂を石灰石と炭酸ナトリウムとともに高温で融解し,冷却することで作られる。○or×
☆以下は解答と解説です。
□A1→ ○
☆解説
同素体ではなく同位体です。同位体とは,原子番号が同じで,中性子の数が異なる原子どうしをいいます。自然界に存在する炭素原子の約99%は,質量数12の同位体です。ごく微量に存在する質量数14の炭素原子は放射性同位体とよばれ,出土品などの年代測定に利用されています。
同素体とは,同じ元素の単体で,性質の異なる物質どうしをいいます。
同素体は,硫黄S,炭素C,酸素O,リンPの4つをおさえましょう。
□A2→ ×
☆解説
炭素Cの同素体であるダイヤモンドと黒鉛(グラファイト)は,共有結合の結晶で融点は非常に高いです。しかし,電気伝導性は黒鉛はありますが,ダイヤモンドにはありません。
☆ダイヤモンドと黒鉛の電気伝導性
ダイヤモンドは炭素原子が正四面体の中心と各頂点に位置した立体構造となっており,炭素原子の価電子4個すべてが原子間の共有結合に使われているので,電気伝導性はありません。
一方,黒鉛は炭素原子が3個の価電子を使い,正六角形の網目状に結合し平面構造をつくっています。この平面が幾つも重なり合った層状の結晶をつくっているのです。
このため,炭素原子に残った1個の価電子が,平面構造に沿って移動できるので,黒鉛には電気伝導性があります。
☆ダイヤモンドと黒鉛の用途
ダイヤモンドは,宝石として重宝される他に,天然の物質の中で最も硬いことから研磨剤などに用いられています。
黒鉛は,層間は結合力が弱い分子間力によって結合しているため,層状にはがれやすく,鉛筆の芯などに用いられています。
□A3→ ○
☆解説
炭素の単体には,ダイヤモンド,黒鉛,フラーレン,カーボンナノチューブ,無定形炭素などの同素体があります。
☆カーボンナノチューブ
黒鉛の層を円筒状に巻いた構造をもつ分子。1991年に日本で発見され,半導体などの電子材料として注目を集めている。
☆無定形炭素
黒鉛の微小な結晶が不規則に配列したもの。脱水剤として用いられる活性炭やカーボンブラック・木炭もその一種。
Image may be NSFW.
Clik here to view.
□A4→ ×
☆解説
ケイ素Siは,地殻中で酸素に次いで2番目に多く存在する元素です。
地殻中の元素の割合の順番は,酸素からナトリウムまでを覚えておくといいでしょう。
☆地殻中の元素の割合(質量%)
O(約50%)>Si(約25%)>Al(約8%)>Fe(約5%)>Ca(約4%)>Na(約3%)
□A5→ ○
☆解説
炭素の単体は天然に存在しますが,ケイ素の単体は,天然には存在せず,酸化物である二酸化ケイ素SiO2を電気炉で融解し,コークスCで還元することによって得られます。
SiO2 + 2C → Si + 2CO
□A6→ ○
☆解説
ケイ素はダイヤモンドと同様に正四面体構造をもつ共有結合の結晶で,灰黒色の金属光沢をもち,融点は高く,硬いがもろいという特徴があります。また,Si-Si結合は,C-C結合に比べて弱く,光や熱によって共有結合が切れて価電子が結晶中に飛び出すため,わずかに電導性を示します。このような物質を半導体といいます。
☆ケイ素の用途
高純度のケイ素の単体は半導体の材料として,IC(集積回路)や太陽電池などに用いられています。
ダイヤモンドとケイ素の共通点・相違点は次のようになります。
Image may be NSFW.
Clik here to view.
□A7→ ×
☆解説
一酸化炭素COは,工業的には約1000℃以上に加熱したコークスCに水蒸気を送ると得られます。
C + H2O ⇔ CO + H2
生成したCOとH2の混合ガスを水性ガスといい,メタノールCH3OHの原料となります。(メタノールは,工業的には,酸化亜鉛ZnOなどの触媒を用いて,水性ガスを高温・高圧下で反応させることにより得られます。)
また,一酸化炭素は,実験室ではギ酸HCOOHに濃硫酸を加えて加熱することで得られます。濃硫酸は脱水作用をもち,HCOOHからH2Oを奪いCOとしています。
□A8→ ○
☆解説
二酸化炭素は,実験室では,石灰石や大理石の主成分である炭酸カルシウムCaCO3に希塩酸を作用させて発生させます。この反応は弱酸の遊離反応です。
このとき,二酸化炭素は水に少し溶け空気より重いため,下方置換で捕集します。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
また,工業的には,石灰石を強熱し熱分解することで得られます。
この反応はアンモニアソーダ法の副反応でもありますね。
□A9→ ×
☆解説
一酸化炭素は,水には溶けにくい気体です。二酸化炭素は水に少し溶け,その一部が水と反応して水素イオンH+を生じるため,弱酸性を示します。
□A10→ ○
☆解説
一酸化炭素は,酸素と比べて血液中のヘモグロビンと200倍以上も強く結合し,血液中の酸素の供給を阻害するため,きわめて有毒な気体です。
二酸化炭素は,大気中に約0.04%(体積)含まれている気体で,年々増加傾向にあり,地球温暖化の原因の1つと考えられています。
□A11→ ×
☆解説
一酸化炭素は,高温では他の物質から酸素を奪って二酸化炭素になりやすく還元性をもちます。
そのため,鉄の精錬などに用いられています。
☆鉄の精錬
Fe2O3 + 3CO → 2Fe + 3CO2
一方,二酸化炭素は,還元性は持ちません。
☆還元作用がある気体
常温:二酸化硫黄SO2,硫化水素H2S,一酸化窒素NO
高温:一酸化炭素CO,水素H2
□A12→ ×
☆解説
液体ではなく,固体の二酸化炭素をドライアイスとよび,気圧1.013×10の5乗Paのもと,-78.5℃で昇華して気体になる性質を利用して,冷却剤として用いられています。
昇華性のある物質は,他にヨウ素I2(黒紫色),ナフタレンC10H8などがあります。
☆昇華性のある物質
ドライアイスCO2,ヨウ素I2,ナフタレンC10H8
□A13→ ○
☆解説
一酸化炭素は,青白いの炎をあげて燃焼し二酸化炭素になります。
一方,二酸化炭素を空気中で点火しても燃焼しません。
□A14→ ○
☆解説
石灰水とは,水酸化カルシウムCa(OH)2の飽和水溶液のことです。
Ca(OH)2水溶液に二酸化炭素を吹き込むと,炭酸塩である炭酸カルシウムCaCO3が白色沈殿するため白く濁ります。
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3に,さらに二酸化炭素を吹き込み続けるとCaCO3の沈殿が溶解します。
CaCO3 + H2O + CO2 ⇔ Ca(HCO3)2
この水溶液を加熱すると,逆反応が起こり,再びCaCO3が白色沈殿します。
一酸化炭素と二酸化炭素の共通点・相違点は次のようになります。
くらべてまとめて覚えましょう。
Image may be NSFW.
Clik here to view.
□A15→ ○
☆解説
二酸化ケイ素SiO2は,ケイ素単体のSi-Si結合がSi-O-Si結合に置き換わった正四面体構造をしています。
また,二酸化ケイ素はシリカとも呼ばれ,天然には石英,水晶,けい砂などとして多量に存在します。
※透明な石英を水晶とよび,砂状の石英をけい砂と呼びます。
□A16→ ×
☆解説
二酸化ケイ素は,共有結合の結晶のため化学的に安定で,ほとんどの試薬に溶けません。しかし,フッ化水素HFおよびフッ化水素酸(フッ化水素の水溶液)にはヘキサフルオロケイ酸H2SiF6を生じて溶けます。
■ 二酸化ケイ素とフッ化水素酸との反応
SiO2 + 6HF → H2SiF6 + 2H2O
☆二酸化ケイ素の用途
二酸化ケイ素は,融点が高く塩酸などの強酸にも侵されないので,試験管やフラスコなどの実験器具やガラス,陶磁器,セメントなどに用いられます。
☆フッ化水素の用途
フッ化水素酸は,二酸化ケイ素を溶かすので,くもりガラスの製造やガラスの目盛り付けに用いられます。そのため,保存の際にはポリエチレンの容器を使用します。
□A17→ ×
☆解説
二酸化ケイ素は酸性酸化物で,水と反応してオキソ酸を生じたり,塩基と反応して塩を生じたりするはずですが,共有結合結晶のため水とは反応せず,塩基とは常温では反応しません。
しかし,高温状態では塩基と反応します。
例えば,二酸化ケイ素に水酸化ナトリウムNaOHや炭酸ナトリウムNa2CO3を加えて加熱融解すると,ケイ酸ナトリウムNa2SiO3が生成します。
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
□A18→ ○
☆解説
ケイ酸ナトリウムNa2SiO3に水を加えて長時間加熱すると,水ガラスという粘性の高い液体が得られます。
□A19→ ×
☆解説
水ガラスの水溶液に塩酸を加えると.白色ゲル状のケイ酸(H2SiO3またはSiO2・nH2O)が遊離します。
この反応は,ケイ酸(弱酸)が遊離する弱酸の遊離反応です。
□A20→ ×
☆解説
シリカではなく,シリカゲルです。シリカは,二酸化ケイ素の別称でしたね。
シリカゲルは,ケイ酸が部分的に脱水縮合して得られます。
シリカゲルには,すきまが多く,親水基のヒドロキシ基-OHをもつので,水分などを吸収(H2OやNH3と水素結合を形成)しやすいため乾燥剤,吸着剤として用いられます。
□A21→ ×
☆解説
石英ガラスは,水晶や石英を高温で融解し冷却して作られます。
ケイ砂を石灰石と炭酸ナトリウムとともに高温で融解し,冷却することで作られのはソーダ石灰ガラス(ソーダガラス)です。
ガラスの主成分は二酸化ケイ素で,ソーダ石灰ガラスは,普通のガラスのことで,ナトリウム(Sodium)と石灰石を含むのでソーダ石灰ガラスとよばれます。
現在,HP『恋する数学』,『恋する化学』でチャートの割引きサービスを実施しております。
この機会に是非お買い求めください。
PR: 損してませんか?まだ仲介手数料払っているあなたへ
| Image may be NSFW. Clik here to view.  |
| ノマドNomad.はあなたの代わりに物件探しをお手伝い。全物件仲介手数料0円! |
期間限定!化学or数学チャートのプレゼントのお知らせ
いつもHP「恋する数学」,「恋する化学」をご覧になっていただきありがとう
ございます!
おかげ様で,オリジナルチャートを実際に目にしたお客様から,お喜び、ご満足の声を頂いて
おります。
そこで,感謝の気持ちを込めまして,『9月期間限定』で
「積分計算早見チャート」(A4サイズ6枚, pdfデータ)
または
「油脂の計算問題 完全攻略チャート」(A4サイズ8枚,pdfデータ)
のいずれかを無料でプレゼント致します!(※pdfデータです。)
ご希望の方は
☆件名に
「無料チャート希望」
☆本文に
・希望するチャート名(「積分計算早見チャート」または「油脂の計算問題 完全攻略チャート」)
・氏名
・年齢
・メールアドレス
を記載して,「gaku-sアットマークh8.dion.ne.jp」までご連絡ください。
追って,ご希望の商品のpdfデータを添付してメール致します。
また,このチャートが気になるのでサンプルを見たい!という方など
お気軽に連絡くださいね。
拙著
『くらべてつなげてまとめる数学 (数学Ⅰ,A,Ⅱ,Bをネットワークでつなぐ)/文英堂』
Image may be NSFW.
Clik here to view.
¥1,296
Amazon.co.jp
も宜しくお願い致します。
テスト
a
ゴムに関する過去問題
■ 天然ゴムの主成分は,イソプレンが〔 ア 〕重合した鎖状構造をもつ一般式(C5H8)nで表される高分子化合物である。この構成単位に含まれる二重結合は〔 イ 〕型の構造をとるため,分子全体が丸まった形となる。また,天然ゴムは,炭素・炭素間の単結合がそれを軸として自由に回転できるために,ゴムを引っ張ると分子が伸びる一方,伸びたポリイソプレンの分子は熱運動のために分子鎖が丸まって縮まろうとする。このように,ポリイソプレンの炭素-炭素間に存在する単結合と二重結合は,ゴムがその性質を示すうえで重要である。
天然ゴムに数%の硫黄を加えて加熱する〔 ウ 〕とよばれる操作を加えると,鎖状の分子が硫黄原子によって〔 エ 〕構造を形成するため,より弾性の大きなゴムとなる。さらに,天然ゴムに大量の硫黄を加えて長時間加熱すると,〔 オ 〕とよばれる黒色の硬い物質が得られ,電球のソケットなどの材料として使われていた。
一方,イソプレンやそれに似た構造をもつ単量体の〔 ア 〕重合によって合成ゴムが得られる。ブタジエンゴムは,1,3-ブタジエンを〔 ア 〕重合させることで得られる。また,アクリロニトリル-ブタジエンゴム(NBR)はアクリロニトリルC3H3Nと1,3-ブタジエンを共重合させることで得られる。これらは耐老化性,耐寒性などが天然ゴムより優れていることから,現在一般的に広く使用されている。
問1 〔 ア 〕~〔 オ 〕に入る最も適当な語句を記せ。
問2 下線部(a)について,空気中の微量のオゾンがゴムを劣化させる大きな原因の1つとなる。この劣化の原因をゴムの化学構造をふまえて,簡潔に記せ。
(2012 京都薬科大学 薬)
□解答
ア…付加, イ…シス, ウ…加硫, エ…架橋, オ…エボナイト
■アセチレンに水を付加させると化合物Aを経て,化合物Bになる。このとき,硫酸水銀を触媒として用いるが,この廃液を海に流出した結果,生じたのが水俣病である。アセチレンにシアン化水素を反応させると,化合物Cができる。また,アセチレン2分子を重合させた化合物に触媒を用いて水素を付加すると,1,3-ブタジエンが得られる。(c)化合物Cと1,3-ブタジエンを混ぜて重合することにより得られる合成ゴムDは耐油性が大きく,耐油ホース,耐油パッキンなどに用いられる。
1.化合物A,B,C,Dについて,その化合物名を記せ。
2.下線部(c)について,このような重合法を何というか。
(2012 慶應義塾大学 医 一部改)
□解答
1.A…ビニルアルコール B…アセトアルデヒド C…アクリロニトリル C…アクリロニトリル-ブタジエンゴム(NBR)
2.共重合
■次の天然ゴムに関する記述(A)から(E)の中から,誤りを含むものをすべて選び,記号で答えよ。
(A) 天然ゴムの主成分であるポリイソプレンは,ほとんどのC=C結合部分でトランス型の構造をとっている。
(B) ゴムの木の樹皮を傷つけて得られる乳濁液(ラテックス)に酢酸などの凝固剤を加え,固まらせたものを生ゴムという。
(C) 空気を断ち,強く加熱することで,ポリイソプレンを分解し,イソプレンを分離して得ることができる。これらの操作を乾留という。
(D) 酸素の同素体であるオゾンは,天然ゴムのC=C結合との反応性に富んでおり,結合の切断によるゴムの劣化を招く。
(E) 天然ゴムに硫黄粉末を加えて処理することを加硫という。これにより,ゴムとしての弾性と溶媒への溶解性をともに向上させることができる。
(2013 芝浦工業大学 工 システム理工 デザイン工)
□解答
(A),(D)
※(A)トランス型ではなくシス型。(D)オゾンではなくて酸素。
■ゴムの木に傷をつけると( ① )という樹液がしみ出してくる。この( ① )に有機酸を加えると沈殿を生じる。この沈殿を水洗,乾燥して天然ゴムが得られる。天然ゴムは( ② )が付加重合した多量体である。(a)天然ゴムの強度や弾性を増すために( ③ )と呼ばれる処理がなされる。
( ② )のメチル基を( ④ )原子に置換して付加重合させたものを( ⑤ )ゴムという。( ⑤ )ゴムは,燃えにくく,耐熱性があり,油にも溶けにくいため,機械部品等に頻用される。( ⑥ )と( ⑦ )との共重合により生じる( ⑧ )ゴムは機械的強度が大きく,自動車のタイヤに用いられる。( ⑥ )と窒素を含む( ⑨ )を共重合させると,耐油性の大きな( ⑩ )ゴムを生じ,石油ホースなどに用いられる。ケイ素と塩素を含む単量体( ⑪ )の重合体を( ⑫ )ゴムという。
問1 ( ① )~( ⑫ )にあてはまる物質名または語句を入れよ。
問2 下線部(a)の操作により天然ゴムの多量体間にどのような化学変化が生じるか。20字以内で述べよ。
(2012 昭和大学 医)
□解答
問1 ① ラテックス ② イソプレン ③ 加硫 ④ 塩素 ⑤ クロロプレン ⑥ ブタジエン ⑦ スチレン ⑧ スチレン-ブタジエン ⑨ アクリロニトリル ⑩ アクリロニトリル-ブタジエン ⑪ ジクロロジメチルシラン ⑫ シリコーン
問2 硫黄により二重結合に架橋構造ができる。
■クロロプレンゴムが生成する場合は,6,6-ナイロンが生成する場合と反応の様式が異なる。どのように異なるか述べよ。
(2012 関西学院大学 教育 総合政策 理工)
□解答
クロロプレンゴムは単量体中に含まれる二重結合の付加重合によって生成するが,6,6-ナイロンはアジピン酸とヘキサメチレンジアミンの縮合重合によって生成する。
■シス型のポリイソプレンを主成分とするのはどれか。
a.天然ゴム b.エボナイト c.クロロプレンゴム d.グッタペルカ e.シリコーンゴム
(2013 東邦大学 医)
□解答
a.天然ゴム
※天然ゴムはほとんどシス形のポリイソプレンでできている。
グッタペルカは,トランス形のポリイソプレンでできている。
エボナイトは黒くて硬く,家具や仏壇の材料となる。
■ 生ゴムの主な成分はポリイソプレンで,二重結合部分の多くがシス型の構造をしている。この生ゴムに3~8質量%の ア を加えて130~140℃で加熱すると,安定で弾性の高いゴムに変わる。
ア の解答群
① 硫 黄 ② エタノール ③ カルシウム ④ 水酸化ナトリウム⑤ 臭 素 ⑥ ナトリウム ⑦ パラフィン ⑧ メタノール⑨ ヨウ素
(2013 明治大学 理工)
□解答
①
■ゴムを大きく2つに分類すると,ゴムノキの樹皮から流出するラテックスに酸を加えて凝固させた A ゴムと,1,3-ブタジエンやイソプレンなどを(b)付加重合させて人工的に作った B ゴムに分かれる。スチレンと1,3-ブタジエンの共重合により生じたSBRは B ゴムに分類され,耐老化性,耐熱性,耐摩耗性に優れ,タイヤなどによく使われている。
問1 A,Bに入る適切な語句を記入しなさい。
問2 Aゴムに硫黄を加えて熱すると,弾性が大きくなり,化学的にも機械的にも強くなった。これは, A ゴムの構造にどのような変化が起こったためか,35字以内で説明しなさい。
(2012 金沢大学 人間社会学域 理工学域 医薬保健学域)
□解答
問1 A…天然 B…合成
問2 ポリイソプレン分子中の二重結合部分に,硫黄原子が架橋構造を作っている。
■実験を行う際に手袋をしようとしたところ,2種類の手袋があった。ひとつは,ゴムの木からとれる乳液(ラテックス)を原料にして作られた天然ゴム手袋である。ラテックスは,高分子化合物のゴムの分子が〔 (ア) 〕状に分散したものである。そのため,酢酸などの酸を加えると,この〔 (ア) 〕粒子が凝集し,生ゴムが生じる。これは,主にイソプレンが〔 (イ) 〕重合した構造をしている。もう1つは,アクリロニトリル-ブタジエンゴム(NBR)で作られた合成ゴム手袋である。これは,①アクリロニトリルと②ブタジエンを〔 (ウ) 〕重合させてつくられた合成ゴム手袋である。NBRはガソリンのような無極性の油に対する耐性に優れており,一般的には〔 (エ) 〕の含有量が増大するほど,その耐性も増大するといわれている。
問1.〔 (ア) 〕と〔 (エ) 〕に当てはまる言葉を書きなさい。
問2.〔 (イ) 〕と〔 (ウ) 〕に当てはまる言葉を下から選び,解答欄に書きなさい。ただし,〔 (イ) 〕と〔 (ウ) 〕には,それぞれ別の言葉を入れなさい。
開環 縮合 付加 脱 共
(2013 九州大学 理)
□解答
問1.ア…コロイド, エ…ベンゼン環
問2.イ…付加, ウ…共
■天然ゴムは,ポリイソプレン構造を有する天然高分子であり,合成ゴムは,炭素数4の( ア )やクロロプレンなどから合成されている。いずれも,重合体に炭素-炭素二重結合が存在する。
問1.文章中の( ア )に適切な語句を入れなさい。
問2.天然ゴムに硫黄を5~8%加えて140℃に加熱すると,化学的にも機械的にも強度が増す。この時に起こる構造変化を50字程度で説明しなさい。
(2012 九州大学 理)
□解答
問1 ア…ブタジエン
問2 天然ゴム中に含まれる炭素原子間の二重結合の部分に,硫黄原子が橋かけをつくるように結合する。
■ゴムはゴムノキの樹液から得られる天然ゴムと,人工的に作り出された合成ゴムに大別される。天然ゴムは,イソプレンが付加重合した ア 形の構造をもつポリイソプレンである。合成ゴムとしては,ブタジエンを付加重合して得られるブタジエンゴムや,クロロプレンから得られるクロロプレンゴム,スチレンとブタジエンを共重合して得られるスチレン-ブタジエンゴムなどが挙げられる。
問1 文中の ア に適切な語句を記せ。
問2 ゴムに5~8%の硫黄を加えて,140℃に熱する処理を加硫という。加硫するとゴムの弾性が高くなる理由を,分子構造に基づいて説明せよ。
(2012 熊本大学 理 医 薬 工)
□解答
問1 ア…シス
問2 硫黄を加えると,鎖状のゴムの分子の間を硫黄原子が結合して架橋構造を形成するため。
■ゴムノキの樹皮に切り傷をつけて得られる乳液に酢酸を加え凝固させたものを生ゴム(天然ゴム)とよぶ。生ゴムは単一の単量体が結合した高分子化合物である。(f)生ゴムを乾留すると単量体が得られる。生ゴムは伸びたり縮んだりする弾性を持つ。(g)この弾性は空気中に長く放置すると失われる。(h)生ゴムに5~8%程度の硫黄を加えて加熱すると,弾性は大きくなる。
問1 下線部(f)について,乾留とはどのような操作か説明せよ。
問2 下線部(g)について,弾性が失われる理由を説明せよ。
問3 下線部(h)について,この操作の名称を書き,弾性が大きくなる理由を説明せよ。
(2013 新潟大学 教育 理 医 歯 工 農 )
□解答
問1 空気を遮断して高温で熱分解させる操作
問2 生ゴム中に含まれる炭素原子間の二重結合が空気中の酸素によって酸化され,分子構造が変化するため。
問3
加硫
理由…生ゴム中に含まれる炭素原子間の二重結合の部分に,硫黄原子が架橋構造を形成すため。
■自動車のタイヤなどに用いられるゴムは,私たちの生活において欠かすことのできない有機高分子の一つである。ゴムノキの樹液から得られる生ゴム(天然ゴム)は分子式[-C5H8-]nで表され,イソプレンが付加重合したポリイソプレンの構造をもっている。(b)[生ゴムに硫黄を加えて加熱]すると,ポリイソプレン分子どうしが硫黄原子により橋かけされ,弾性に富んだ材料となる。
一方,イソプレンに似た構造をもつブタジエン(CH2=CH-CH=CH2)やクロロプレンを付加重合して得られる高分子化合物は,合成ゴムとして広く利用されている。また,スチレンやアクリロニトリル(CH2=CH-CN)をブタジエンと共重合して得られる高分子化合物(それぞれSBRおよびNBRと呼ばれる)も合成ゴムとして利用される。
これらのゴムを構成する高分子に含まれている二重結合が酸素やオゾンと反応すると,ゴムに特有の弾性は失われ,ゴムは劣化する。耐候性や耐薬品性を高めるために,SBRやNBRに含まれるブタジエンの単位部分の二重結合を水素化した水素化SBRや水素化NBRも製造されている。また,イソブチレンに少量のイソプレンを加えて共重合させたブチルゴムや,シリコーン樹脂と類似した重合体に橋かけ構造を導入したシリコーンゴムなど,くり返し単位(くり返し構造単位)に二重結合を含まない合成ゴムもつくられている。
問 下線部(b)の処理を何と呼ぶか。最も適切な語句を記せ。
( 2013 広島大学 教育 理 医 歯 薬 工 生物生産 )
□解答
加硫
■生ゴムに硫黄を加えて加熱すると,弾性が大きくなり機械的に強くなる。その理由を述べよ。
(2013 横浜市立大学 医)
□解答
理由…生ゴム中に含まれる炭素原子間の二重結合の部分に,硫黄原子が架橋構造を形成すため。
■イソプレン(2-メチル-1,3-ブタジエン)C5H8は,ブタジエン分子の端から2番目の炭素原子に結合した水素原子をメチル基で置換した化合物である。イソプレンを 2 させると,ブタジエンと同様な反応が起こり,イソプレンゴムが生成する。イソプレンゴムの炭素原子鎖(主鎖)には4種類の基本的な繰り返し単位が形成される。分子の片方の二重結合だけが反応した場合には,2種類の繰り返し単位ができる。また,両方の二重結合が反応に関与し,分子の両端で結合した場合には,シス型およびトランス型の2種類の繰り返し単位ができる。
天然ゴム(生ゴム)もイソプレンが 2 した構造を持ち,その繰り返し単位はシス型である。 ゴムは,弱い力で長く伸び,力を取り除けば元に戻るというゴム特有の 4 を示すので,天然ゴムやいろいろな合成ゴムが手袋,タイヤ,ホース,ガスケット,パッキンなどに用いられている。
問1 上の文章中の 1 ~ 3 に当てはまる適切な語句を答えなさい。
問2 上の文章中の 4 に当てはまる適切な語句は何か,次の(ア)~(オ)の中から1つ選び,記号で答えなさい。
(ア) 展 性 (イ) 潮解性 (ウ) 延 性 (エ) 弾 性 (オ) 粘 性
(2013 琉球大学 教育 理 医 農 )
□解答
問1 1…付加反応 2…付加重合
問2 (エ) 弾 性
■ ポリイソプレンはイソプレンを単量体とする付加重合により合成される重合体(ポリマー)であり,その主鎖中にC=C二重結合を有する構造をしている。その二重結合が A 型の重合体は一般にゴム弾性を示す。一方,グタペルカと呼ばれる B 型の二重結合を有する重合体は,かたくて弾性にとぼしい。ゴム弾性を示すポリイソプレンに硫黄の粉末を反応させることを C というが,これによって溶剤への溶解性を低下させ,またゴム弾性を改善することができる。
問 A ~ C に入る言葉を記せ。
(2009 愛媛大学 医 教育 工 農 理)
□解答
A…シス B…トランス C…加硫
■ 天然ゴムの糸におもりをぶら下げて引っ張った状態にすると,ゴムの中の高分子は比較的伸びた形状になる。この状態のゴム糸を加熱すると,全体の長さがどのように変化するか,適切なものを下記の選択肢から選び,その記号を解答欄に記せ。また,そのような変化が起こる理由について,「分子の熱運動」と関連させて80字以内で説明せよ。
[選択肢]
(あ) 伸びる, (い) そのまま, (う) 縮む
(2009 富山大学 医 工 薬 理)
□解答
(う) 縮む
理由…引っ張られて,伸びた状態の天然ゴムを加熱すると,分子の熱運動が激しくなり,引っ張られる前の折れ曲がった状態に戻ろうとするため。
■炭素と炭素の二重結合をもたないため加硫の操作を行わなくても高い耐老化性を示す合成ゴムを次の(ア)~(ウ)の中から一つ選び,記号で答えよ。
(ア) ブタジエンゴム (イ) シリコーンゴム (ウ) クロロプレンゴム
(2010 新潟大学 医 教育 工 歯 農 理 )
□解答
(イ) シリコーンゴム
※シリコーンゴムは単結合だけからなる鎖状の高分子化合物。
■天然ゴム(生ゴム)は (シ) が付加重合した線状の構造をもっている。硫黄を加え,この線状の構造を網目状構造(架橋構造)にし,化学的安定性を増すための処理を (ス) という。 (ス) により有機溶媒に溶けにくくなり,弾性が (シ) なる。一方,天然ゴムと似た構造をもつ合成ゴムも広く利用されている。たとえば,スチレンと (ソ) の共重合物であるスチレン- (ソ) ゴム(SBR)は,タイヤや工業用品として用いられている。
問3 文中の (シ) ~ (ソ) に当てはまる語句を記せ。
(2010 福井大学 工)
□解答
(シ) イソプレン (ス)加硫 (セ)強く (ソ)ブタジエン
■ゴムノキの樹液である (ア) に酸を加えて得られる生ゴム(天然ゴム)を乾留すると A が生成する。合成ゴムは,この A とよく似た構造を持つ1,3-ブタジエンあるいはクロロプレンを,それぞれ (イ) 重合してブタジエンゴムあるいはクロロプレンゴムとしたものである。また,アクリロニトリルと1,3-ブタジエンとを (ウ) 重合させると,アクリロニトリル-ブタジエンゴムが得られる。いずれのゴムも野外で長い間放置すると,紫外線と (エ) との影響で弾性が失われていく。
1.(ア)~(エ)に適切な語句を記せ。
2.Aの物質名を記せ。
(2010 法政大学 デザイン工 生命科 理工)
□解答
(ア)ラテックス (イ)付加 (ウ)共 (エ)酸素
A 天然ゴム(生ゴム)
■石油などを原料としてつくられる合成高分子化合物から,天然に存在する高分子化合物の長所を再現した種々の素材が人工的に得られる。ゴムでは,天然ゴム(生ゴム)のような性質をもつ合成ゴムがつくられている。
たとえば,aイソプレンに似た構造をもつ1,3-ブタジエンやbクロロプレンから,それぞれ付加重合によって,ブタジエンゴムやクロロプレンゴムが得られる。さらに,生ゴムと同様のc加硫という操作を加えることによって,適度な強度と弾性をもつゴムが得られる。
(1) 下線部cの加硫とはどのような操作であるか。その内容を簡潔に記しなさい。また,加硫という操作によってゴムの弾性が増す理由を簡潔に記しなさい。
(2011 秋田大学 工学資源 )
□解答
(1)
内容…少量の硫黄を加えて加熱する操作
理由…高分子鎖間に硫黄原子による架橋構造が形成されるから。
■高分子化合物は,その組成や分子の構造により分類される。有機物である高分子化合物は有機高分子化合物という。また,高分子化合物のうち,天然に存在するものを天然高分子化合物,人工的に合成されたものを合成高分子化合物という。
ゴムノキの傷つけた樹皮から流出する白い乳液である( ア )に酸を加えて凝析させると,天然ゴム(生ゴム)が得られる。天然ゴムは( イ )が重合した構造をとる。天然ゴムは分子中に( ウ )を持っており,この部分が酸素により酸化されると,構造が変化し,しだいに弾性を失い劣化する。天然ゴムに( エ )を5~8%加えて加熱すると,化学的にも機械的にも強くなる。天然ゴムの構造を参考にして,クロロプレンゴムなどの合成ゴムがつくられている。
問1 文中の( ア )~( ク )にあてはまる語を記しなさい。
(2011 大分大学 医)
□解答
(ア)ラテックス (イ)イソプレン (ウ)二重結合 (エ)硫黄
■ゴムの木の樹皮に切り傷をつけると,ラテックスが流れ出てくる。これを集めて ア を加えると,凝固して イ になる。これが天然ゴムである。a天然ゴムの主成分は ウ であり, エ 形の構造をもつ。 イ
にイオウを加えて加熱することにより,弾性の高いゴムを作ることができる。bこのような操作を オ という。さらに多くのイオウを加え加熱すると,この物質は カ なる。
ウ の単量体に似た構造をもつ単量体を重合させると,天然ゴムに似た性質の合成ゴムが得られる。合成ゴムであるブタジエンゴムやクロロプレンゴムは,それぞれの単量体を キ させることによってつくられる。
問1 空欄 ア ~ キ に当てはまる最も適切な語句を次の①~⑯から選び,番号で答えよ。
① アルカリ ② 酸 ③ シリコーンゴム ④ 生ゴム ⑤ ポリスチレン
⑥ ポリイソプレン ⑦ ポリプロピレン ⑧ トランス ⑨ シス ⑩ 水素化
⑪ 加硫 ⑫ かたく ⑬ やわらかく ⑭ 縮合重合 ⑮開環重合 ⑯ 付加重合
問2 下線部bのような操作によって天然ゴムに何という構造が形成されるかを記せ。
(2011 群馬大学 工)
□解答
ア…② 酸, イ…④ 生ゴム, ウ…⑥ ポリイソプレン, エ…⑨ シス, オ…⑪ 加硫, カ…⑫ かたく, キ…⑯ 付加重合, 問2 架橋構造(三次元立体網目構造)
※問題は一部省略,変更しています。
現在,HP『恋する数学』,『恋する化学』でチャートの割引きサービスを実施しております。
この機会に是非お買い求めください。
PR: 損してませんか?まだ仲介手数料払っているあなたへ
| Image may be NSFW. Clik here to view.  |
| ノマドNomad.はあなたの代わりに物件探しをお手伝い。全物件仲介手数料0円! |
壁orノートに貼って覚えるポイント・まとめ集
『壁orノートに貼って覚えるポイント・まとめ集』の無機化学編と有機化学編を販売開始しました!
■特徴1
全国の国公立私大の入試問題(過去7年分)が入力されたデータベースソフトを用いて,徹底的に入試に出るポイントを分析。
■特徴2
他の参考書には載っていない,見たことのないようなポイントやまとめ表を掲載。
例えば……
□X線の遮蔽剤といえば?
X線の造影剤と言えば?
マニアックな知識ではなく,これらは意外と入試で出題されています!
こんな形で掲載
↓ ↓ ↓ ↓
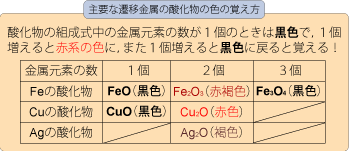
□硫化カドミウムCdS,クロム酸鉛(Ⅱ)PbCrO4,酸化亜鉛ZnO,硫酸バリウムBaSO4,酸化鉄(Ⅲ)Fe2O3
これらに共通する用途は?
こんな形で掲載
↓ ↓ ↓ ↓
□ケイ素Si,リンP,硫黄Sの単体にうち天然に存在するものは?
こんな形で掲載
↓ ↓ ↓ ↓
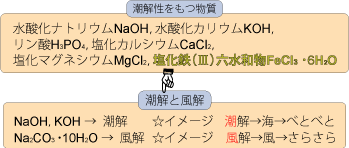
□水酸化ナトリウムNaOH,水酸化カリウムKOH,リン酸H3PO4,塩化カルシウムCaCl2,塩化マグネシウムMgCl2,塩化鉄(Ⅲ)六水和物
これらの物質に共通する性質は?
こんな形で掲載
↓ ↓ ↓ ↓
□6つの主要なアセトンの製法を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□2つの主要な乾留の反応を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
■特徴3
くらべてつなげてまとめる表を多数掲載
人間の脳は、事柄と事柄をシナプスで繋ぎ、記憶していくことから、英単語などを記憶する際には、グループごとに分類したり、関連するイメージでつなげて覚えていくと、効率的に語彙を増やし、忘れにくいことなどが知られています。
そこで,くらべてつなげて覚えられるようにまとめました。
例えば……
こんな形で掲載
↓ ↓ ↓ ↓
■特徴4
豊富な色を使用。
化学は,呈色反応や化合物などの色を問う問題がよく出題されることから,色がついた文字色を何度も見ることによって記憶がより定着します。
例えば……
□白煙が生じる2つの反応を挙げられますか?
こんな形で掲載
↓ ↓ ↓ ↓
□銅と銀の主要な化合物の色を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□典型・遷移金属の主要な酸化物の色を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□主要な水和物の色を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
■特徴5
「キーワード連想」を掲載
当然ながら、入試は時間が勝負です。
そこで,あるキーワードがでたら,ポイントがすぐに連想できるようになるようにまとめました。
例えば…
□天然ガスから分離 or 沸点が最も低い or イオン化エネルギーが最も大きい or 最も理想気体に近い気体とあったら?
□空気中で最も多く存在する希ガスとあったら?
□白色顔料,医薬品,化粧品とあったら?
□黒い多量のススとあったら?
□果実の成熟作用,植物ホルモンとあったら?
□強い光を放って燃焼とあったら?
こんな形で掲載
↓ ↓ ↓ ↓
Image may be NSFW.
Clik here to view.

★他にも掲載している例を紹介します。
□リン酸カルシウムからリン酸までの反応の流れが言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□二酸化ケイ素からシリカゲルまでの反応の流れが言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□次の酸のうち揮発性の酸はどれですか?
硝酸,塩酸,フッ化水素酸, 酢酸,濃硫酸
こんな形で掲載
↓ ↓ ↓ ↓
□希硫酸と濃硫酸の性質を言えますか?
こんな形で掲載
↓ ↓ ↓ ↓
□無機化学において,水素が発生する頻出の反応を何個挙げられますか?
こんな形で掲載
↓ ↓ ↓ ↓
□次のアルミニウムに関する用語を説明できますか?
ボーキサイト,アルマイト,アルミナ,ジュラルミン,テルミット
こんな形で掲載
↓ ↓ ↓ ↓
□混同しやすい無水物の生成反応
こんな形で掲載
↓ ↓ ↓ ↓
□有機化合物のにおい
こんな形で掲載
↓ ↓ ↓ ↓
□ナトリウムフェノキシドの2つの生成反応
こんな形で掲載
↓ ↓ ↓ ↓
□有機化合物で登場する水酸化ナトリウムNaOHの反応
こんな形で掲載
↓ ↓ ↓ ↓
□混同しやすい有機化合物の反応
こんな形で掲載
↓ ↓ ↓ ↓
□こんな図表とか
↓ ↓ ↓ ↓
これらはほんの一部です!
この『壁orノートに貼って覚えるポイント・まとめ集』を壁やノートに貼って毎日眺めることで暗記が大幅に短縮できます!
pdfデータ形式になっているので,何枚でもプリントでき,いろんなところに貼ったり,携帯することができます。
絶対にお得です!
下記は,有機化学編の表紙(A4サイズ)です。
Image may be NSFW.
Clik here to view.

下記は,無機化学編のサンプル(A4サイズ)です。
Image may be NSFW.
Clik here to view.

下記,DLマーケットよりご購入いただけます。
【壁orノートに貼って覚えるポイント・まとめ集 有機化学編】
pdfデータ(A4サイズ 12枚) 価格 1,200円
【壁orノートに貼って覚えるポイント・まとめ集 無機化学編】
pdfデータ(A4サイズ 17枚) 価格 1,200円
『芳香族化合物の異性体 完全攻略チャート&過去問解説集』の販売を開始しました。
久しぶりの更新です。
化学の教材作りに集中していたため,しばらく更新できませんでした。
お待たせしました(^O^)/。
皆さんのご要望が多かった
『芳香族化合物の異性体 完全攻略チャート&過去問解説集』
がようやく完成し販売を開始しました。
芳香族化合物の異性体問題は,有機化合部の最頻出テーマの1つで,総合的な知識を必要とするため受験生が苦手とするところです。
「完全攻略チャート&過去問解説集」は過去に出題された国公立・私立大学の入試問題15年分をデータベースソフトを使い徹底的に分析(この分析作業に長時間かかってしまいます。゚(T^T)゚。)し,「よく出る分子式」ついて,
おさえておくべき異性体,解法パターン,反応による生成物,ベンゼン環の水素1個を置換した異性体の数,呈色反応でわかりやすくまとめています。
芳香族化合物の異性体についてこれだけわかりやすくまとめたものはないでしょう!
自信を持っておすすめします。
■具体的な内容
チャート① 有機化合物の構造決定の主な流れ(Ⅰ.有機化合物の元素分,Ⅱ.C,H,Oの質量の計算,Ⅲ.組成式(実験式)の決定,Ⅳ.分子式の決定,Ⅴ.構造式・示性式の決定)
チャート② 異性体とは?構造異性体とは? 立体異性体とは? 幾何異性体(シス-トランス異性体)とは? 立体異性体とは?
チャート③ 光学異性体とは? 頻出の芳香族化合物の分子式と考えられる異性体
チャート④ 芳香族化合物の異性体問題のよく見られる出題パターンと解法の手順
チャート⑤ C8H10の異性体
チャート⑥ C7H8Oの異性体
チャート⑦ C8H10Oの異性体
チャート⑧ C8H8O3の異性体
チャート⑨ C9H10O2の異性体
過去問題は
2009年~2013年までに出題された過去問題を解説しています。
これだけ丁寧にわかりやすく解説しているものは他にはありません。
□収録出題校
旭川医科大学(2012年),横浜国立大学(2009年),岡山大学(2013年),関西大学(2012年),関西学院大学(2010年),京都産業大学(2012年),近畿大学(2013年),金沢大学(2012年),高知大学(2013年),大阪市立大学(2010年,2013年),筑波大学(2012年),同志社大学(2011年),立命館大学(2011年)
チャートと過去問解説集で2次試験対策は万全です!
A4高級厚紙 全9枚+A4普通紙 全20枚
価格 800円
商品はHP「恋する化学」からご購入いただけます。
pdfデータをほしい方は下記よりご購入いただけます。
【芳香族化合物の異性体 完全攻略チャート&過去問解説集】
Image may be NSFW.
Clik here to view.
★感謝の気持ちを込めまして,『12月期間限定』で
「積分計算早見チャート」(A4サイズ6枚, pdfデータ)
または
「油脂の計算問題 完全攻略チャート」(A4サイズ8枚,pdfデータ)
のいずれかを無料でプレゼント致します!(※pdfデータです。)
ご希望の方は
☆件名に
「無料チャート希望」
☆本文に
・希望するチャート名(「積分計算早見チャート」または「油脂の計算問題 完全攻略チャート」)
・氏名
・年齢
・メールアドレス
を記載して,「gaku-sアットマークh8.dion.ne.jp」までご連絡ください。
追って,ご希望の商品のpdfデータを添付してメール致します。
また,このチャートが気になるのでサンプルを見たい!という方など
お気軽に連絡くださいね。
拙著
『くらべてつなげてまとめる数学 (数学Ⅰ,A,Ⅱ,Bをネットワークでつなぐ)/文英堂』
Image may be NSFW.
Clik here to view.
¥1,296
Amazon.co.jp
も宜しくお願い致します。
「化学平衡に関する問題 徹底分析チャート&過去問題解説集」の販売を開始しました。
昨日に続き,「化学平衡に関する問題 徹底分析チャート&過去問題解説集」の販売を開始しました。
おかげさまで好評を得ている
「徹底分析チャート&過去問題解説集」とはどういうものか?
【もう一度,あなたが志望する大学の入試問題を見てみて下さい!】
☆授業や参考書・問題集でやった問題がそっくり出ていますか?
☆今までにやったことのない問題に戸惑ってはいませんか!
例えば,数学で,因数分解をマスターするのに,まずは基本問題から始まり,複雑な応用問題をたくさん解きマスターしますよね。
化学も同様で,あるジャンルを確実にマスターするためには,最低でも過去問題を10題以上は解かなくてはいけません。
しかし!!
皆さんは市販の参考書や問題集に載っている基本レベル程度の問題を数題やっただけでわかった気になっているのです。
もう一度,あなたが受ける大学の過去問を見てください!
☆授業や参考書・問題集でやった問題がそっくり出ていますか?
☆今までにやったことのない問題に戸惑ってはいませんか?
参考書に載っている基本レベル程度の問題を解いただけでは,中堅レベル以上の大学では,到底太刀打ちできないのです!
☆実際の入試問題では,手を変え品を変え,趣向を凝らした様々な問題が出題されています。
☆当然,出題する側も過去に出題された問題の数値を変えた程度では,出題するわけにはいきません。
はっきり言っちゃいます!
化学をなめるな!!!!!!!!!!!
そこで
「完全攻略チャート&過去問解説集」を活用してみませんか!
☆この「完全攻略チャート&過去問解説集」は,データベースソフトを使い,膨大な入試問題を徹底的に分析し,どのような出題傾向があるのか を調べ上げ,その解法を色や図を使って、
「これでもか!」というくらいに,分かりやすくまとめたものです。
☆恐らく,「こんな出題タイプがあるのか!」と驚かれるのではないかと思います。
☆この「完全攻略チャート&過去問解説集」は,はっきり言って,どの参考書や問題集よりも分かり易いものであると自負しております。
☆百聞は一見に如かずです。騙されたと思って一度,目にして下さい!
今回の「化学平衡に関する問題 徹底分析チャート&過去問題解説集」は,
受験生が最も苦手とし,入試で最も差がつく分野であると言えます。
しかし,出題タイプと解法パターンさえ頭に入れておけば,そう難しくはありません。
本チャートは,過去に出題された国公立・私立大学の入試問題15年分をデータベースソフトを使い徹底的に分析し,次のように,出題タイプを大きく5通りに分類し,これ以上ないくらいにわかりやすく,まとめました。
■出題タイプ
Ⅰ.濃度平衡定数を求めるタイプ
ⅱ.反応前と平衡時の一部の物質量がわかっているタイプ
ⅲ.圧平衡定数がわかっているタイプ
Ⅳ.圧平衡定数を求めるタイプ
Ⅴ.濃度平衡定数と圧平衡定数との関係式を求めるタイプ
↓↓↓実際のチャートの一部はこんな感じです。↓↓↓もちろん,これだけではなく他にもいっぱい!
Image may be NSFW.
Clik here to view.
過去問題は
2010年~2013年までに出題された過去問題を解説しています。
これだけ丁寧にわかりやすく解説しているものは,他にはありません。
□収録出題校
東京理科大学(2011年),愛媛大学(2013年),旭川医科大学(2012年),関西大学(2010年),岩手大学(2012年),九州工業大学(2012年),広島大学(2012年),静岡大学(2013年),早稲田大学(2011年),徳島大学(2012年),北海道大学(2011年),同志社大学(2011年),名古屋大学(2012年),明治屋大学(2011年)
チャートと過去問解説集で2次試験対策は万全です!
A4高級厚紙 全11枚+A4普通紙 全26枚
価格 800円
どの参考書よりもわかりやすく解説しています!!
絶対に損はさせません!
商品はHP「恋する化学」からご購入いただけます。
pdfデータをほしい方は下記よりご購入いただけます。
【化学平衡に関する問題 完全攻略チャート&過去問解説集】
Image may be NSFW.
Clik here to view.
□下記が収録している過去問題です。
■ 広島大学(2012 教育 理 医 工 農)
次の文章を読み,問いに答えよ。計算問題を解答する場合には有効数字に注意し,必要ならば四捨五入すること。
圧力を一定に保つことができる密閉容器に,2.00molのCOと1.00molのO2を入れて高温で反応させたところ,CO2が生成し次式で示される平衡状態に達した。このとき,混合気体が占める体積は1.00×102Lであった。
2CO + O2 ⇔ 2CO2
(ⅰ) 平衡状態にあるCO,O2,CO2のモル濃度をそれぞれ[CO],[O2],[CO2]と表すとき, 平衡定数Kを表す式を記せ。
(ⅱ) 平衡状態にあるO2のモル濃度は1.00×10-3mol/Lであった。このときの平衡定数Kの値を有効数字2桁で求めよ。単位も記せ。
↓↓↓過去問解説集はこんな感じで解説しています。↓↓↓
Image may be NSFW.
Clik here to view.
■ 東京理科大学(2011 2/5,B方式 理工)
次の記述(1)(2)の(ⅰ),(ⅱ)にあてはまる数値を,有効数字が2桁になるように3桁目を四捨五入して求めなさい。
また,記述中の(ア)(イ)について最も適当なものを{ }内から選びなさい。
(1) 体積可変の無色透明な密閉容器がある。この容器に0.50molのN2O4を封入し,体積を2.5Lにした。その後,ある温度に保ったところ,0.25molのN2O4が解離してNO2が生成し,平衡状態と なった。この反応の濃度平衡定数は (ⅰ) mol/Lである。この時,容器中の気体の色は, (ア){1 無色から褐色へと変化した 2 褐色から無色へと変化した 3 褐色のまま変化しなかった 4 無色のまま変化しなかった}。
(2) (1)の状態から温度,体積を一定に保ったまま,さらに2.5molのN2O4を添加し,新たな平衡状態に到達させた。この時,容器内に存在するNO2の物質量は (ⅱ) molである。
平衡到達後の混合気体中に占めるNO2の割合は,(イ){1 (1)の時よりも大きくなった
2 (1)の時よりも小さくなった 3 (1)の時と同じであった}。
■愛媛大学 (2013 教育 理 医 工 農 )
問題を解くのに必要があれば,下記の数値を用いなさい。
原子量 H=1.0, N=14.0, O=16.0, 気体定数 R=8.31×103Pa・L/(K・mol)
赤褐色の気体の二酸化窒素NO2から無色の気体の四酸化二窒素N2O4が生成する反応
2NO2(気体) = N2O4(気体) + 57.2kJ
について,問に答えなさい。ただし,数値は有効数字3桁で答えなさい。
問1 密閉容器内において25℃でこの反応が平衡に達している。
(1) 全圧を変えずに温度を上げると,平衡はどちらの方向に移動するか。下記の(ア)~(ウ)の中から適切な記述を選び記号で答えなさい。
(ア) N2O4が増える方向に移動する (イ) N2O4が減る方向に移動する (ウ) 移動しない
(2) (1)のように考えた理由を50字程度で述べなさい。
問2 1.00Lの容器にNO2とN2O4の混合気体5.06gが入っていて,平衡に達している。平衡定数が0.500(mol/L)-1であるとすると,NO2とN2O4のモル濃度はそれぞれいくらか。その過程を示して答えなさい。
■旭川医科大学 (2012 後期日程 医 )
計算結果は有効数字3桁で示しなさい。
問 気体の水素(H2)とヨウ素(I2)を一定体積の密閉した容器に入れ一定温度に保つと,ヨウ化水素が生成し,平衡に達する。
(1) 体積1Lの容器に水素とヨウ素をそれぞれ1.20mol入れて密閉し,一定温度に保った。
平衡に達したときのヨウ化水素は1.90molであった。平衡定数を求めなさい。また,その計算過程も記しなさい。
(2) この平衡は圧力を加えるとどうなるか,理由も付けて50字程度で答えなさい。
■岡山大学 (2013 教育 理 医 歯 薬 工 農 他 )一部改
3.0molのH2と2.3molのI2を体積50Lの容器に入れ,高温で一定温度に保つと平衡状態に達し,4.0molのHIが生じた。
(1) 下線で示す反応の平衡定数を有効数字2桁で答えよ。
(2) この反応系に触媒を加えるとどうなるか。次の(Ⅰ)~(Ⅳ)の( )内から適当な語句 を選び,記号で答えよ。
(Ⅰ) 活性化エネルギーは(①小さくなる ②大きくなる ③変化しない)
(Ⅱ) 反応熱は(①小さくなる ②大きくなる ③変化しない)
(Ⅲ) HI生成反応の速度は(①小さくなる ②大きくなる ③変化しない)
(Ⅳ) 反応の平衡は(①右向きに移動する ②左向きに移動する ③どちらにも移動しない)
■関西大学(2010 システム理工 化学生命工他)
( (1) )には式の右辺を,( (2) )および( (3) )には小数第1位までの数値を,( (4) )は(ア)~(ウ)から1つ選べ。
エタンは高温でエチレンと水素に熱分解される。この熱分解反応は①式で表される。ただし,①式以外の反応は起こらないものとする。
C2H6(気) ⇔ C2H4(気) + H2(気) ……①
ここで,エタン,エチレンおよび水素のモル濃度[ mol/L]をそれぞれ[C2H6],[C2H4]および[H2]とすると,①式の反応の平衡定数KC[ mol/L]は②式で表される。
KC = ( (1) ) ……②
次に,体積500Lの容器にエタン,エチレンおよび水素を入れ,温度と体積を一定に保つと平衡状態に達した。この平衡時のエタンの物質量は1.0mol,エチレンの物質量は3.0mol,水素の物質量は
2.0molであった(平衡状態2)。したがって,このとき
KC = ( (2) )×10-2 mol/L ……③
と求まる。 さらに,平衡状態2の混合気体にエタンを6.0mol,水素を6.0mol加え,平衡状態2と同じ温度と体積に保つと,新たな平衡状態に達した。平衡到達後のエタンの物質量は③式の値を用いて( (3) )molと求まる。したがって平衡は( (4) )ことがわかる。(ア)右向きに移動した (イ)左向きに移動した (ウ)移動しなかった
■ 岩手大学 (2012 教育 )
次の文章を読み,問1~問4に答えよ。気体はすべて理想気体とする。
二酸化窒素NO2は,式(1)のような可逆反応によってその一部が四酸化二窒素N2O4となる。
2NO2 ⇔ N2O4 ……(1)
また,この反応の熱化学方程式は式(2)で表される。
2NO2 = N2O4 + 57.2kJ ……(2)
純粋なNO2をピストンのついた透明な容器にn0[mol]だけ注入した。
そのときの容器内の圧力をP0,温度をT,体積をVとする。温度と体積を一定に保って,①平衡状態に到達させると全圧はP1となり,NO2の物質量はn1[mol]であった。
問1.温度T における式(1)の反応の平衡定数(濃度平衡定数)Kcを,n0,n1,Vを使って表せ。
問2.下線①の平衡状態でのNO2とN2O4の分圧を,それぞれn0[mol],n1[mol],P0を使って表せ。
問3.下線①の平衡状態から温度を一定に保ったままピストンを押し込むとNO2の物質量はどう変化するか。理由と共に述べよ。
問4.下線①の平衡状態から体積を一定に保って温度を上昇させると気体の色はどうなるか。理由と共に述べよ。
■ 九州工業大学(2012 工 情報工 )
水素とヨウ素を密閉容器に入れ,ある温度に保つと,ヨウ化水素が生じ,式(1)のような平衡状態に達する。以下の問いに答えよ。
H2 + I2 ⇔ 2HI ……(1)
問1 体積100Lの容器に水素5.5molとヨウ素4.0molを入れると,平衡状態に達し,ヨウ化水素7.0mol が生じた。式(1)の反応の平衡定数はいくらになるか。有効数字2桁で答えよ。
問2 問1と同じ温度で体積150Lの容器に水素5.0molとヨウ素5.0molを入れると,平衡状態に達した。 その時,ヨウ化水素は何mol生じたか。有効数字2桁で答えよ。
■ 早稲田大学(2011 一般(B方式) 人間科 )
問 1.0molずつの酢酸とエタノールに少量の濃硫酸を加え,ある一定温度で反応させたところ,酢酸エチルが0.60mol生成した時点で,反応が平衡状態に達した。一方,酢酸1.2molおよびエタノール( A )molについて,同じ温度でこの反応を行ったところ,酢酸エチルが0.60mol生成して平衡状態に達した。このとき,反応の平衡定数は( B )である。
A群:
① 0.13 ② 0.27 ③ 0.73 ④ 0.87 ⑤ 1.7
B群:
⑥ 0.11 ⑦ 0.25 ⑧ 0.44 ⑨ 2.3 ⑩ 4.0
■ 東京理科大学(2011 2/4,B方式 理工)
次の記述(1)~(3)の(ア)~(ウ)にあてはまる数値を,有効数字が3桁になるように4桁目を四捨五入して求め,必要ならば下記の数値を用いなさい。平方根の概数値:ルート3=1.732
(1) 酢酸とエタノールから酢酸エチルと水を生成する反応の25℃における平衡定数は4.00である。いま,酢酸1.00molとエタノール1.00molの混合物にごく少量の濃硫酸を加えて25℃に保ち平衡に達したとき,反応に用いた酢酸の (ア) %が酢酸エチルになると計算される。
(2) (1)の混合物にさらにエタノール1.00molを加えて25℃に保ち平衡に達したとき,酢酸エチルの物質量は (イ) molとなる。
■ 同志社大学(2011 数・理重視型・理系型)
反応物と生成物がともに理想気体であり,反応が平衡状態にある場合には,各成分気体の濃度の代わりに,分圧を用いて平衡定数を表すことができる。この平衡定数を圧平衡定数といい,
Kpで表される。
2SO2 + O2 ⇔ 2SO3
で示される反応の圧平衡定数は,ある温度でKp=2.7×10-3Pa-1であった。この温度において,反応が平衡状態にあるとき,SO2の分圧が1.0×104Pa,O2の分圧が3.0×104Paであった。このとき,全圧はいくらか。有効数字2桁で求めよ。
■ 北海道大学(2011年 医 歯 獣医 水産 他)
必要があれば,次の数値を用いよ。気体定数:8.3×103Pa・L/(K・mol)
問1 水素とヨウ素からヨウ化水素が生成する反応を,内容積1.0Lの容器を用い,圧力と温度をそれぞれ100kPa,610Kに保って行った。水素とヨウ素の分圧は,反応開始時にはいずれも50kPa であったが,ある時間経過した後にはいずれも10kPaの一定値であった。生成したヨウ化水素の物質量[mol]を有効数字2桁で求めよ。
問2 問1における反応の平衡定数(K)を有効数字2桁で求めよ。
★感謝の気持ちを込めまして,『12月期間限定』で
「積分計算早見チャート」(A4サイズ6枚, pdfデータ)
または
「油脂の計算問題 完全攻略チャート」(A4サイズ8枚,pdfデータ)
のいずれかを無料でプレゼント致します!(※pdfデータです。)
ご希望の方は
☆件名に
「無料チャート希望」
☆本文に
・希望するチャート名(「積分計算早見チャート」または「油脂の計算問題 完全攻略チャート」)
・氏名
・年齢
・メールアドレス
を記載して,「gaku-sアットマークh8.dion.ne.jp」までご連絡ください。
追って,ご希望の商品のpdfデータを添付してメール致します。
また,このチャートが気になるのでサンプルを見たい!という方など
お気軽に連絡くださいね。
拙著
『くらべてつなげてまとめる数学 (数学Ⅰ,A,Ⅱ,Bをネットワークでつなぐ)/文英堂』
Image may be NSFW.
Clik here to view.
¥1,296
Amazon.co.jp
も宜しくお願い致します。
「溶解度積に関する問題 徹底分析チャート&過去問題解説集」の販売を開始しました。
溶解度積に関する問題も化学平衡,電離平衡と並んで,受験生が最も苦手とする分野の1つで,入試で差がつく分野であると言えます。
しかし,溶解度積を詳しく解説している参考書が少なく,出題タイプが整理して頭に入ってないために,少し問題をひねられると途端に解けなくなってしまいます。
本チャートは,過去に出題された国公立・私立大学の入試問題を15年分をデータベースソフトを使い徹底的に分析し,次のように,出題タイプを大きく4通りに分類し,これ以上ないくらいにわかりやすくまとめました。
■出題タイプ
Ⅰ.溶解度積を求めるタイプ
純水に対する難溶性塩の溶解度(1L中に溶けることができる限界量(mol))から溶解度積Kspを求めるタイプ
Ⅱ.溶解度を求めるタイプ
ⅰ.純水タイプ
難溶性塩の純水に対する溶解度を求めるタイプ。
ⅱ.共通イオンを含む水溶液タイプ
難溶性塩の共通イオン(ある電解質を構成するイオンと同じ種類のイオン)を含む水溶液に対する溶解度を求めるタイプ。共通イオンを含んだ溶液中でも溶解度積の式は成立する。
Ⅲ.結晶が沈殿し始めるのモル濃度を求めるタイプ
溶液Aに溶液Bを少しずつ加えていったとき,結晶が沈殿し始めるときのイオンのモル濃度を求めるタイプ。
Ⅳ.沈殿が生成するか否かを問うタイプ
溶液Aと溶液Bを混合したときに沈殿が生成するか否かを問うタイプ。
過去問題は
2009年~2013年までに出題された過去問題を解説しています。
これだけ丁寧にわかりやすく解説しているものは,他にはありません。
□収録出題校
東北大学(2009年),愛知教育大学(2010年),横浜国立大学(2009年),岩手大学(2012年),宮崎大学(2013年),佐賀大学(2013年),静岡大学(2009,2012年),千葉大学(2010年),大阪教育大学(2012年),筑波大学(2013年),島根大学(2009年),徳島大学(2012年),和歌山大学(2010年)
どの参考書よりもわかりやすく解説しています。
A4高級厚紙 全6枚+A4普通紙 全16枚
商品はHP「恋する化学」からご購入いただけます。
pdfデータが欲しい方はDLマーケットよりご購入いただけます。
Image may be NSFW.
Clik here to view.
Image may be NSFW.
Clik here to view.
★感謝の気持ちを込めまして,『12月期間限定』で
「積分計算早見チャート」(A4サイズ6枚, pdfデータ)
または
「油脂の計算問題 完全攻略チャート」(A4サイズ8枚,pdfデータ)
のいずれかを無料でプレゼント致します!(※pdfデータです。)
ご希望の方は
☆件名に
「無料チャート希望」
☆本文に
・希望するチャート名(「積分計算早見チャート」または「油脂の計算問題 完全攻略チャート」)
・氏名
・年齢
・メールアドレス
を記載して,「gaku-sアットマークh8.dion.ne.jp」までご連絡ください。
追って,ご希望の商品のpdfデータを添付してメール致します。
また,このチャートが気になるのでサンプルを見たい!という方など
お気軽に連絡くださいね。
拙著
『くらべてつなげてまとめる数学 (数学Ⅰ,A,Ⅱ,Bをネットワークでつなぐ)/文英堂』
Image may be NSFW.
Clik here to view.
¥1,296
Amazon.co.jp
も宜しくお願い致します。
あけましておめでとうございます。
皆様、新年あけましておめでとうございます。
今年も宜しくお願い致します。
年末は休みなく、電離平衡の教材をつくっていました。
緩衝溶液の公式(水素イオン濃度)の語呂合わせ暗記法を考えながらウトウト
していたところ
ぱっと「ラーメン間食し、塩分過多」というワードが浮かんできました。
濃度Ca(mol/L)の酢酸CH3COOHと濃度Cs(mol/L)の酢酸ナトリウムCH3COONa
の混合溶液の水素イオン濃度[H+]は
[H+]=(Ca/Cs)×Ka
Ka:(酢酸の電離定数)
となりますが、
「塩の濃度」分の「酸の濃度」× Ka と覚えるのを
を『間食(緩衝)し 塩(Cs)分 過(Ca) 多(Kaのa)』 と覚える…。
うーん、いまいちかな…。
もっといい語呂合わせを考えてみます。
今後、オリジナルの語呂合わせ暗記法をまとめてみようかなとも思ってみます。
受験生は今が一番苦しい時期かと思います。
先を考えると不安でいっぱいかもしれませんが、
今できることに集中して、今、今を生きてほしいと思います。
近日中に
「くらべてつなげてまとまとめる有機化学・無機化学」の参考書のpdfデータと
「結晶に関する問題 完全攻略チャート&過去問解説集」、「電離平衡 完全攻略チャート&過去問解説集」
の販売ができるかと思います。
今しばらくお待ちください。
今年も宜しくお願い致します。
資料収集のため国会図書館へ
今日は、化学の教材の資料集めに国会図書館に行った。
Image may be NSFW.
Clik here to view.
資料は30冊くらい閲覧したいが、閲覧できるのは1回の請求でたった3冊までしかできない!
しかも…
その3冊をパソコンから請求し、届くまでに30分ほどかかる。
また資料のコピーにも20分ほどかかる。
今日は仕事終わりの夕方から来て、閲覧できたのは6冊のみ。
国会図書館は日曜日は休みだし、平日はなかなか来れないし
資料集めには一苦労。
「せめて5冊に改善してくれ~!」
国会図書館の目の前にある国会議事堂に向かって吠える!
Image may be NSFW.
Clik here to view.
お役所仕事だから、意見を陳情しても変わらないだろうなぁ…。
PR: 安全な空の旅のために、お出かけ前に確認を!-政府広報
| Image may be NSFW. Clik here to view.  |
| 普段の生活で何気なく使っている品物も、飛行機の中では「危険物」に!詳しくはこちら |
円周率πと円周の長さの公式
皆さんは
「円周率π(パイ)の定義は?」
「円周の長さの公式(半径とπを用いた公式)は?」
と問われて答えられますか?
馬鹿にするな!と思う人もいるかもしれませんが、意外と答えられない人
が多いのではないかと思います。
ある調査では、円周率πの定義が明確に言えるのは、中高大・社会人含めて半数を切るとも言われています。
その原因は、教わり方、覚え方にあると思います。
円周率は、円の周長の直径に対する比率(ウィキペディアより)なのですが、
私は、次のように教えています。
「まず、目を閉じて頭の中に円を思い浮かべてください。
次に、その円の直径の長さをイメージしてください。
次に、円周の長さをイメージし、その円周の一箇所を切って、まっすぐに伸ばしてください。
そして、まっすぐに伸ばした円周と直径の長さを比較してみてください。
当然、直径より円周の長さの方が長いことはイメージできると思いますが、
円周は直径の何倍くらいになると思いますか?」
とこのように相手に何倍になるかをイメージさせます。
おそらく、大半の人が2倍~3.5倍くらいの間で答えるでしょう。
そこで、イメージさせた後に
答えは
「3.141592……(倍)」
この永遠につづく数をπと呼ぶことにしたのだよ!
と教えます。
すると、ほとんどの人が「あっそうなんだ!」と納得してくれます。
こうイメージさせて覚えると
冒頭に聞いた
「円周率π(パイ)の定義は?」
「円周の長さの公式は?」
も答えられるのではないかと思います。
つまり、
直径の長さにπを掛けたら円周の長さ
→「円周の長さ=(半径の長さ)×2×π」
ですね。
このようにイメージさせて覚えると、一生忘れないのではないでしょうか。
いかがでしょうか?
円の面積の覚え方については後ほど。
尿素に関する入試問題
携帯アプリゲーム「クイズRPG 魔法使いと黒猫のウィズ」をやっていたら,
尿素に関するマニアックな問題が出題されていた。
Q.尿素を工業的に作る場合に原料となる物質は、アンモニアと何?
1.メタン 2.塩酸 3.二酸化炭素 4.水
皆さんわかりますか?
化学を専攻している受験生は
知っていなければいけない知識です。
答えは,
二酸化炭素
です。
尿素は,有機化学の歴史上非常に重要な化合物で,
我々の日常生活においても,肥料や保湿クリームなどとして広く利用されています。
しかし,受験生の多くが尿素の合成法や化学式について知りません。
そこで今日は,尿素について解説したいと思います。
尿素は,人類が初めて無機化合物のみから合成された有機化合物として,有機化学の歴史上非常に重要な化合物です。
その合成に成功した人は,フリードリヒ・ウェーラーで,彼は, 1828年にシアン酸アンモニウムの水溶液を加熱して尿素を生成しました。
では,尿素に関する問題は,大学の入試問題ではどの程度出題されているのか?
気になったので
データベースソフトを使い調べてみました。
分析の結果,おおまかに分類すると
① 沸点上昇・浸透圧に関する問題
② 尿素の合成に関する問題
③ 尿素樹脂(ユリア樹脂)に関する問題
3つになります。
①のポイントは
尿素は非電解質(イオンに分かれない物質)であるということ。
②のポイントは
尿素は,アンモニアを高温・高圧下で二酸化炭素と反応させて合成するということ。
反応式は必ず書けるようにしてください。
③のポイントは
尿素樹脂は,尿素とホルムアルデヒドから合成され,
尿素樹脂(尿素のことを英語でureaというのでユリア樹脂ともいう。)は熱硬化性樹脂であるということです。
では,実際に出題された入試問題のごく一部を紹介します。
★☆★①沸点上昇、浸透圧に関する問題★☆★
■ 2012 日本女子大学
1.8gのブドウ糖C6H12O6を100gの水に溶かした溶液がある。同圧のもと,このブドウ糖溶液の沸点にもっとも近い沸点を示す溶液を,次のa~cから選び,記号で答えよ。計算過程も記せ。
a.塩化ナトリウム1.5gを水500gに溶かした溶液
b.ショ糖C12H22O11 8.5gを水500gに溶かした溶液
c.尿素(NH2)2CO 3.6gを水500gに溶かした溶液
※ブドウ糖も非電解質ですね!
■2013 福岡大学 理 工 医 薬
問6 次の(1)~(4)を用いて同じ質量パーセント濃度の希薄な水溶液をそれぞれ調製したとき,最も沸点が高くなるのはどれか。番号で答えよ。
(1) 尿素(NH2)2CO(2) グリセリンC3H5(OH)3
(3) グルコースC6H12O6(4) スクロースC12H22O11
■2010 日本大学 A方式 薬
次の物質①~⑤のうち,1gを水に溶かして1Lにしたとき,最も浸透圧が高いものはどれか。
① 塩化ナトリウム(58.5)② 塩化カルシウム(111)
③ ガラクトース(180)④ スクロース(342)
⑤ 尿素(60)
■2013 東京都市大学 知識工 環境 メディア情報 都市生活
問 次のa~dの水溶液の沸点の大小関係を正しく表したものを下の①~⑧のうちから1つ選べ。ただし,原子量は,H=1.0,C=12.0,N=14.0,O=16.0,Na=23.0,Cl=35.5,K=39.1とする。 22
a 水1kgに尿素(NH2)2CO 4.0gを溶かした水溶液
b 水1kgに塩化ナトリウムNaCl 4.0gを溶かした水溶液
c 水2kgにグルコースC6H12O6 18.0gを溶かした水溶液
d 水0.5kgに硝酸カリウムKNO3 2.0gを溶かした水溶液
① a>b>c>d② a>c>d>b③ b>a>c>d④ b>d>a>c
⑤ c>a>b>d⑥ c>d>b>a⑦ d>a>b>c⑧ d>b>c>a
■2012 東京薬科大学 薬男子部 薬女子部
(1) 水1000gに尿素(NH2)2CO3.00gを溶かすと,沸点は何K上昇するか。最も近い値をa~eから選びなさい。
a 0.0258b 0.0515c 0.103d 0.155e 0.206
■2009 東邦大学 医
問 以下の水溶液で最も沸点が高いのはどれか。
a.グルコース(分子量180)10gを500gの水に溶かした水溶液
b.0.17mol/kgのグルコース水溶液
c.尿素(分子量60.1)4.0gを500gの水に溶かした水溶液
d.塩化ナトリウム(式量58.5)6.0gを1.0kgの水に溶かした水溶液
e.0.08mol/kgの塩化カルシウム(式量111)水溶液
■ 2009 北里大学 海洋生命科 獣医
問4 同じ質量の化合物をそれぞれ水1kgに溶解させた水溶液(a)~(d)がある。同圧下で水溶液の沸点が低い順に並んでいるのは,①~⑤のうちどれか。ただし,電解質は水溶液中で完全に電離しているものとする。 4
(a) 硫酸ナトリウム(Na2SO4)水溶液(b) 尿素(NH2)2CO水溶液
(c) グルコース(C6H12O6)水溶液(d) 硝酸カリウム(KNO3)水溶液
① (b)<(c)<(d)<(a)② (c)<(b)<(a)<(d)
③ (c)<(b)<(d)<(a)④ (d)<(a)<(b)<(c)
⑤ (d)<(a)<(c)<(b)
■2009 九州産業大学 情報科 工
の化合物のうち,その0.1mol/kg水溶液の沸点上昇度が最も小さいものはどれか。
(イ) 尿素(ロ) 塩化カルシウム
(ハ) 硫酸(ニ) 塩化ナトリウム
(ホ) 酢酸ナトリウム
■2013 神戸薬科大学 薬
問 水100gに溶かした尿素の質量[g]はいくらか。次の中から最も近い値を選べ。ただし,1.013×105Paにおける水のモル沸点上昇を0.52K・kg/molとする。(1) 0.050(2) 0.18(3) 0.50(4) 1.1(5) 1.8
(6) 3.0(7) 11(8) 30
----------------------------------------------------
☆★☆②尿素の合成に関する問題☆★☆
■2012 大阪市立大学 理 工 医 生活科
次の(あ)~(お)の中から,二酸化炭素とアンモニアのそれぞれに対する記述として適切なものをすべて選び,記号を記せ。同じ記号を重複して選んでもよい。
(あ) 水溶液が塩基性を示す。(い) 空気より軽い。
(う) 無色・無臭である。(え) 両性酸化物である。
(お) 尿素をつくる原料として使われる。
答え
(2)二酸化炭素 (う),(お)アンモニア (あ),(い),(お)
■2009 自治医科大学 医
ドイツの化学者ウェーラーは有機化学の発展に大きく貢献する業績を残した(1828年)。その業績はどれか。
(ア) ベンゼンの正六角形構造を提唱した。
(イ) 無機化合物から有機化合物である尿素を合成した。
(ウ) 天然絹に似た合成繊維としてナイロンを合成した。
(エ) 必要な光学異性体だけを合成する不斉合成法を開発した。
(オ) アニリンから人工染料を合成した。
■ 2013 上智大学 総合人間科
動植物は古くから有機体とよばれてきた。動植物の生命活動を維持する物質の一つである A ,日常生活で使用されている B 製品はすべて C からできている。
19世紀初めまでは,有機体から得られた炭素を含む化合物を C といっていて,それらは生命の力によってのみつくられて,人工的にはつくれないと考えられていた。そして,有機体とは無関係にできた D と区別されていた。しかし,1828年に ア は, D であるシアン酸アンモニウムの水溶液を濃縮することにより C である尿素が得られることを発見した。
問 A ~ J に最も適当な語句をa)~p)からそれぞれ1つ選べ。該当する選択肢がない場合は,z欄をマークせよ。
a) アルカンb) アルケンc) アルキン
d) アルコールe) エーテルf) アセチレン(エチン)
g) エチレン(エテン)h) エタン i) プロピン
j) 炭化水素k) 芳香族化合物l) 無機化合物
m) 有機化合物n) 炭水化物o) ガラス
p) プラスチック
問17 ア にあてはまる人名をa)~g)から1つ選べ。該当する選択肢がない場合は,z欄をマークせよ。
a) ウェーラーb) ケクレ c) ドルトン
d) パスツールe) ファラデーf) メンデレーエフ
g) リービッヒ
■2013 名城大学 薬
問 触媒を必要とする合成反応を選びなさい。
a.一酸化炭素と水素からメタノールを合成する。
b.アセチレンに塩化水素を付加し,塩化ビニルを合成する。
c.希硫酸中臭化カリウムを酸化マンガン(Ⅳ)で酸化し,尿素を合成する。
d.二酸化硫黄を空気中の酸素で酸化し,三酸化硫黄を合成する。
e.アンモニアと二酸化炭素から尿素を合成する。
■2013 岩手大学 教育
下線②で生産されている窒素肥料の1つである尿素は,高温高圧下でアンモニアと二酸化炭素から合成される。この反応の反応式を書け。
■2013 神戸薬科大学 薬
問 次の記述のうち,正しいもののみをすべて含む組み合わせはどれか。
(a) ギ酸およびベンズアルデヒドは,いずれもアルデヒド基をもつため,還元性を示す。
(b) ニトロベンゼンは窒素原子をもつため,塩基性を示す。
(c) アセトンおよびメタノールは,いずれもヨードホルム反応を示す。
(d) 尿素は,無機物であるシアン酸アンモニウムの加熱により生じる有機物である。
(1) [(a)](2) [(b)](3) [(c)](4) [(d)]
(5) [(a),(b)](6) [(a),(c)](7) [(a),(d)](8) [(b),(c)]
(9) [(b),(d)](10) [(c),(d)]
■ 2012 金沢大学理工学域
およそ100年前までは,窒素肥料の原料は ケ または石炭乾留の際に生じるアンモニアだけであったが,1906年,(a)ハーバー・ボッシュ法により窒素ガスと キ ガスからアンモニアの化学合成が成功したことで様相が一変した。このアンモニアを原料に ア と反応させて尿素が,オストワルト法によりアンモニアを酸化して コ が合成され,窒素肥料として使われている。また, コ は当時ノーベルの発明したダイナマイトの材料としても使われた。
問1 文中の ア ~ コ にあてはまる最も適切な語句を記入しなさい。
■2009 埼玉大学 工 理
工業的には,アンモニアから硝酸アンモニウム(硝安)や硫酸アンモニウム(硫安)などの窒素肥料が製造されている。また,尿素も窒素肥料として用いられる。⑤尿素は,アンモニアと二酸化炭素を高温・高圧で反応させて合成される。
(h) 下線部⑤でおこる反応の化学反応式を書け。
----------------------------------------------
★☆★③ 尿素樹脂(ユリア樹脂)に関する問題★☆★
■2012 大阪府立大学 工学域
次の(ア)~(カ)の高分子化合物のうち,熱的な性質から熱硬化性樹脂に分類されるものをすべて選び,記号で答えよ。
(ア) ポリエチレン(イ) メラミン樹脂(ウ) ポリ塩化ビニル
(エ) ナイロン66(オ) 尿素樹脂(カ) 不飽和ポリエステル
答え
(イ),(オ),(カ)
■ 2010 日本大学 薬
アルデヒドに関する次の記述a~eのうち,正しいものの組合せはどれか。
a.アセトアルデヒドは,アンモニア性硝酸銀溶液を酸化し,銀を析出させる。
b.アセトアルデヒドは,フェーリング液を加えて加熱すると,酸化されて酢酸の塩を生じる。
c.高温高圧下で,リン酸を触媒としてエチレンに水を付加させると,アセトアルデヒドが生じる。
d.2-プロパノールを硫酸酸性の二クロム酸カリウム水溶液で酸化すると,プロピオンアルデヒドが生じる。
e.尿素とホルムアルデヒドを縮合重合させると,尿素樹脂が生じる。
① (a,b)② (a,c)③ (a,d)④ (a,e)
⑤ (b,c)⑥ (b,d)⑦ (b,e)⑧ (c,d)
⑨ (c,e)⑩ (d,e)
■2010 日本大学 薬
合成樹脂の説明として誤りを含むのは, 23 である。
<解答群>
① ポリエチレンはエチレンを付加重合させて作る。
② ポリスチレンはスチレンを縮合重合させて作る。
③ 尿素樹脂(ユリア樹脂)は尿素にホルムアルデヒドを加え,加熱した溶液に濃硫酸を加え縮合重合させて作る。
④ メタクリル樹脂はメタクリル酸メチルCH2=C(CH3)-COOCH3を付加重合させて作る。
⑤ メラミン樹脂はメラミンC3N3(NH2)3とホルムアルデヒドを縮合重合させて作る。
■2013 法政大学: デザイン工 理工 生命科
熱を加えると軟らかく,冷やすと硬くなる性質をもつ高分子化合物を次の選択肢から一つ選び,記号で記せ。
a.フェノール樹脂b.メラミン樹脂
c.ユリア樹脂(尿素樹脂)d.スチロール樹脂(ポリスチレン)
e.エポキシ樹脂
■ 2009 香川大学 医 教育 工 農
問 次のア~オのうち,熱硬化性樹脂はどれか。あてはまるものの記号を全て答えなさい。
ア.尿素樹脂 イ.フェノール樹脂 ウ.ポリエチレンテレフタラートエ.メタクリル樹脂
オ.メラミン樹脂
■ 2009 群馬大学 工
問 次の高分子化合物①~⑧のうち,下線部dの熱硬化性樹脂に当てはまる高分子化合物をすべて選び,その番号を答えよ。
① ポリアクリロニトリル② ビニロン
③ フェノール樹脂④ 尿素樹脂
⑤ ポリ塩化ビニル⑥ ポリカーボネート
⑦ 不飽和ポリエステル⑧ アセテート
■2012 信州大学 理 繊維
a) 尿素樹脂は,尿素と何から得られるか答えよ。
b) 尿素樹脂を合成する際に,加熱処理すると硬化する理由を述べよ。
--------------------------------------------------
☆★☆その他の問題☆★☆
■2013 自治医科大学 医
次のうちヨードホルム反応とフェーリング反応を共に示すのはどれか。
(ア) 乳酸 (イ) 尿素(ウ) エタノール(エ) ホルムアルデヒド (オ) アセトアルデヒド
■2013 立教大学程 理
次の分子のうち,非共有電子対(孤立電子対)の数が1番多いものはどれか。
a.アセトンb.アニリンc.キシレンd.ジエチルエーテル
e.尿素
■2010 早稲田大学 人間科
問 次の文を読み,最も不適切なものを次の①~⑥から二つ選びなさい。
①アミラーゼは麦芽や大豆に存在する酵素であり,その生成物はマルトースのみである。
②ペプシンはタンパク質を加水分解する酵素であるが,最適pHは8であり,その反応部位はアルギニンやリシンなどの結合部位である。
③ 緑色植物は,6CO2 + 6H2O C6H12O6 + 6O2という反応によってグルコースを生産している。このような反応を炭酸同化作用という。
④ATPとADPとRNAは,リン酸とリボースを持っている。
⑤アセトアニリドはかつて解熱剤として広く使われたが,赤血球を溶解するなどの副作用がある。現在はアセトアニリドの構造の一部を変化させた薬剤が使われている。
⑥保湿剤に配合されているグリセリンや尿素は,分子内のヒドロキシ(ヒドロキシル)基やアミノ基などが,水分子と水素結合をつくることによって,水の蒸発を防ぐとされている。
(答え ①,②)
★お知らせ
「くらべてつなげてまとめる化学シリーズ」の問題集+参考書
・くらべてつなげてまとめる無機化学 第一部(pdfデータ 196ページ)
・くらべてつなげてまとめる無機化学 第二部(pdfデータ 133ページ)
・くらべてつなげてまとめる有機化学 第一部(pdfデータ 157ページ)
・くらべてつなげてまとめる有機化学 第二部(pdfデータ 138ページ)
と
「完全攻略チャート&過去問解説集シリーズ」の最新作
・結晶格子に関する問題 完全攻略チャート&過去問解説集
の販売を開始しました。
HP 恋する化学
よりお買い求めいただけます。
宜しくお願い致します。
海水に関する問題
前回に続き,携帯アプリゲーム「クイズRPG 魔法使いと黒猫のウィズ」で出題された問題から。
Q.次の物質を、海水に含まれる量が多い順に並べ替えなさい。
1.水 2.塩化ナトリウム 3.塩化マグネシウム 4.硫酸カルシウム
どうでしょうか?
うーん…、この問題,厳密には問題があります。
海水中に存在するのは,イオンの状態であって,塩化カルシウムや塩化マグネシウムなどの塩(えん)として存在しているわけではありません。
塩は蒸発させたときに残る固体です。
よって,厳密には
「混合物である海水がどのような純物質から構成されているか。多い順に並べよ。」
としなければいけないでしょう。ちょっと苦しいですが。
一応、答えは,
1.水⇒2.塩化ナトリウム⇒3.塩化マグネシウム⇒4.硫酸カルシウムの順となります。
(水=96.6%,塩分3.4%(塩化ナトリウム=77.9%,塩化マグネシウム=9.6%,硫酸カルシウム=4.0%,その他) wikipediaより)
前回に続いて,大学の入試問題では,海水に関してどんな問題が出題されているのか,データベースソフトを用い調べてみました。
分析の結果,おおまかに分類すると
① 物質の種類に関する問題
② 分離・実験装置に関する問題
③ セッケンの洗浄力に関する問題
④ 溶液の濃度に関する問題
⑤ 浸透圧に関する問題
⑥ イオン交換膜に関する問題
の6つになりました。
①のポイントは
海水は混合物である!ということ。
純物質……1種類の物質からなる物質。
混合物……純物質が2種類以上混じり合ってできた物質。
純物質は,さらに単体と化合物に分けられる。
単体……1種類の元素で構成されている物質。例……C,O2,N2,Ag
化合物…2種類以上の元素で構成されている物質。例……H2O,NaCl,CH4
★純物質と混合物の見分け方のポイント
① 1つの化学式で表せるものが純物質となる。例えば,海水は,水(H2O),塩化ナトリウム(NaCl), 塩化マグネシウム(MgCl2)などからなるので混合物と判断できる!
② 融点・沸点が一定の値を示す物質は,純物質。一定の値を示さない物質は混合物。
混合物の融点・沸点は,成分物質の混合の割合によって変わる!
②のポイントは
海水から純粋な水を取り出す操作は蒸留となること。
蒸留とは?
液体を含む混合物を加熱し,沸騰させてできる蒸気を冷却することにより,液体を分離する操作を蒸留という。
特に,2種類以上の液体の混合物を,沸点の違いを利用して物質ごとに分離する操作を分留という。
例えば,蒸留は,海水から水を取り出す場合,溶けている塩化ナトリウムNaClなどは蒸発しないが,水は蒸発するため,水を分離することができる。
③のポイントは
セッケンはMg2+やCa2+と反応して水に不溶な塩をつくるため,硬水や海水を用いるとセッケンの洗浄力は低下するということ。
④⑤⑥については,長くなるので別の機会に解説します。
では,実際に出題された入試問題のごく一部を紹介します。
★☆★① 物質の種類に関する問題★☆★
■2012 立命館大学 2/3,理系A方式 理工 情報理工 生命科 薬
・文章中の下線部(c)について,物質を分離・精製する方法には蒸留の他にもいろいろな方法がある。
混合物の分離・精製に関する文章のうち正しいものを下の選択肢からすべて選び,その番号を解答用紙にマークせよ。
① 再結晶は,有機化合物の精製には適用できない。
② 抽出により,食塩とナフタレンの混合物からナフタレンをとり出すことができる。
③ 抽出により,アニリンとフタル酸の混合物からそれぞれの化合物を分離することはできない。
④ クロマトグラフィーにより,o-キシレンとフェノールの混合物からそれぞれの化合物を分離することができる。
⑤ 蒸留により,エタノールと海水の混合物からエタノールをとり出すことはできない。
⑥ 昇華により,ナフタレンとベンゼンの混合物からナフタレンをとり出すことができる。
答え
②,④
■2012 明治大学 一般 農
・以下の文章(ア)~(エ)の目的に適する分離方法の組み合わせは ① である。
(ア) 少量の塩化ナトリウムを含む硝酸カリウムの水溶液から純粋な硝酸カリウムを精製する。
(イ) 海水から純粋な水を取り出す。
(ウ) ナフタレンと塩化ナトリウムの混合物からナフタレンを液体の状態を経ずに分離する。
(エ) ヨウ素を含むうがい薬からヘキサンを用いてヨウ素を分離する。
①
(ア)(イ)(ウ)(エ)
A昇 華ろ紙によるろ過蒸 留昇 華
B昇 華抽 出蒸 留抽 出
C再結晶抽 出昇 華蒸 留
D抽 出ろ紙によるろ過抽 出蒸 留
E再結晶蒸 留昇 華抽 出
F抽 出蒸 留抽 出昇 華
答え
(3) E
■2012 東邦大学 理
・次の(ア)~(ウ)の混合物から[ ]内に示した純物質を取り出すのにもっとも適した方法を,以下の(a)~(e)からそれぞれ一つずつ選び記号で答えよ。
(ア) 海水[水](イ) お茶[カフェイン]
(ウ) 少量の塩化ナトリウムを含む硝酸カリウム[硝酸カリウム]
(a) ろ過 (b) 蒸留 (c) 再結晶 (d) 昇華 (e) 抽出
■2009 東京理科大学 理工
・次の(ア)~(シ)に最も適当なものをA欄から選びなさい。
海水から真水を作るとき,まず砂や固体浮遊物を (ア) により分離する。得られた液体は真水と同じように見えるが,その中には各種無機塩類が溶解している。このことは例えば,この液体に (イ) 水溶液を1,2滴落とすと白い (ウ) の沈殿が見られ,
さらに,この液体を白金線に付けてガスバーナーの外炎に入れると (エ) による黄色の (オ) が見られることから確認できる。
次にそれら無機塩類を除くために,図の装置で (カ) をおこなう。図中の器具Aは (キ) ,器具Bは (ク) 冷却器,器具Cは (ケ) という。
図中の温度計の球部は,ⅰ~ⅲの中の (コ) の高さに置く。加熱するときに守るべきことは (サ) ことである。また,冷却器の使用方法で守るべきことは
(シ) ことである。この操作によって海水中の水は蒸発して水蒸気になり,冷却器で冷やされてほぼ純粋な水が得られる。
A 欄
01 ⅰ02 ⅱ
03 ⅲ04 アジャスター
05 アダプター06 アンモニア
07 カリウム08 キップ
09 ナトリウム10 フェーリング液
11 ベックマン12 マグネシウム
13 メスフラスコ14 リービッヒ
15 レトルト16 枝つきフラスコ
17 塩化アンモニウム18 塩化銀
19 塩化鉄(Ⅲ)20 塩化ナトリウム
21 炎色反応22 蛍 光
23 再結晶24 硝酸銀
25 蒸 留26 水酸化鉄(Ⅲ)
27 水酸化銅(Ⅱ)28 炭酸カルシウム
29 沈 殿30 抽 出
31 沸 騰32 分 留
33 丸底フラスコ34 硫酸銅(Ⅱ)
35 リン光36 ろ 過
37 ガスバーナーの赤い炎で熱する38 沸騰石を入れて穏やかに沸騰させる
39 はやく蒸発させるために強めに熱する
40 冷却水をaから入れてbから流出させる
41 冷却水をbから入れてaから流出させる
■2013 神戸薬科大学 薬
・海水から水を取り出す操作として適切なものは,次のうちどれか。
(a) ろ過 (b) 昇華 (c) 再結晶 (d) 抽出 (e) 蒸留
■2010 富山県立大学 工
次の文中の( ① )~( ⑥ )に適当な語句を記入せよ。また,( ア )に適当な文章を説明文(a)~(e)から選び記号で答えよ。
純物質は,単体と( ① )に分類される。( ① )はその作り方や存在場所が異なっても,成分元素の質量比は一定である。
これを( ② )の法則といい,1799年にフランスの( ③ )が発見した。
海水から水を分離するには,海水に溶けている物質と水の( ④ )が異なることを利用して( ⑤ )という操作を行うとよい。
そのために,枝付きフラスコに海水を入れて加熱し,発生した水蒸気を冷却器で( ⑥ )させて三角フラスコに集める。
その時の注意事項として誤りを含んだ文章は( ア )である。
(a) 海水の量は枝付きフラスコの容積の3分の1程度にする。
(b) 温度計の先端の球部は枝付きフラスコの底に触れないように海水中に入れる。
(c) 冷却水は下方から上方へ流す。
(d) 急激な沸騰(突沸)を防ぐため,沸騰石を入れておく。
(e) 枝付きフラスコはバーナーで直接加熱せず,間に金網を入れる。
答え
① 化合物② 定比例③ プルースト④ 沸点⑤ 蒸留⑥ 疑縮
ア (b)
■2009 京都教育大学 教育
物質は純物質と混合物に分類される。純物質はさらに,単体と化合物に分類される。
次の1)~3)を実現するために,混合物あるいは化合物からある特定の物質を取り出す方法を説明せよ。図を用いて説明してもよい。
ただし,通常の実験室で可能な簡単な実験方法が望ましい。また,取り出した特定の物質を分析して同定する必要はない。
1) 海水から,できるだけ純度の高い水を得る。
2) 酸化鉄から,できるだけ純度の高い鉄を得る。
3) 不純物を含む純度の低い粗銅から,純銅を得る。
★☆★② 分離・実験装置に関する問題★☆★
■ 2012 東京都市大学 工 知識工 環境情報 都市生活
問 ア~エのうち,混合物はどれか。最適な組み合わせを下の①~⑧のうちから1つ選べ。 13
ア ドライアイスイ 牛乳ウ 海水エ ダイヤモンド
① アとイ② アとウ③ アとエ④ イとウ
⑤ イとエ⑥ ウとエ⑦ アとイとウ⑧ イとウとエ
答え
④
■2010 自治医科大学 医
・次のうちで,混合物のみ,または化合物のみからなる組み合わせはどれか。
A:オゾン,塩酸,花こう岩B:石油,石灰水,空気
C:水,ドライアイス,アンモニアD:黒鉛,エタノール,塩化ナトリウム
E:ショ糖,海水,食酢
(ア) AとB(イ) BとC(ウ) CとD(エ) DとE
(オ) AとE
■2012 大阪医科大学 看護
問 単体,化合物,混合物の組み合わせとして正しいものはどれか。次のa~eのうちから一つ選びなさい。
単体化合物混合物
a酸素石灰水青銅
bグルコースセッコウ海水
cナトリウム白金ヨウ素液
d水素ベンゼン発煙硫酸
eアルミニウム塩化ナトリウム次亜塩素酸
■2012 上智大学 理工
私たちの身の回りにある多くの物質は,2種類以上の物質が混じり合ったものであり,このような物質を A という。空気や海水は A である。
問1 文中の A ~ G にあてはまる語句をa)~s)からそれぞれ1つ選べ。該当する選択肢がない場合,あるいは選択肢が複数ある場合は,z欄をマークせよ。
a) 異性体b) 化合物c) 希釈d) 揮発e) 凝縮
f) 原子g) コロイドh) 混合物i) 重合体j) 純物質
k) 蒸留l) 精製m) 単体n) 単量体o) 同位体
p) 同族体q) 同素体r) 複塩s) 沸騰
■2010 岩手大学 教育
次の文(ア)~(カ)のうち,下線部の記述の誤っているものを3つ選び,記号で答えよ。
また,誤りを含む下線部を,それぞれ正しい記述に直せ。
(ア) 原子量が約40で,原子核の中性子の数が陽子の数より4個多い原子の原子番号は,18である。
(イ) 一酸化窒素と二酸化窒素のように,同じ元素の組み合わせでできている性質の異なる物質を,同素体という。
(ウ) 食塩は固体状態では電気を通さないが,加熱して融解するとナトリウムと塩素の間で電子が授受されるので,電気をよく通す。
(エ) プロパン6.60gを完全燃焼させたとき生じる二酸化炭素は,標準状態で約10.1Lである。
(オ) 海水,食塩水,酢酸,硝酸,石油,エタノールのうち,純物質は酢酸とエタノールである。
(カ) 酸素分子O2の全電子数はネオン原子Neの電子数と同じなので,O2は安定に存在する。
★☆★③ セッケンの洗浄力に関する問題★☆★
■2010 関東学院大学 人間環境
27~35に当てはまるものを下記の語群①~⑩から選べ。
油脂をけん化して得られる 27 は 28 性部分の炭化水素基と 29 性のイオン部分からなる 30 のナトリウム塩である。
水中でその一部が 31 して弱 32 性を示す。 27 は硬水や海水中ではCa2+や 33 と結合し水に不溶性の塩を作るので使用できない。
この点を改良したのが合成洗剤である。合成洗剤には 34 のナトリウム塩や,高級 35 の硫酸エステルのナトリウム塩などがある。
[語群]
① アルコール ② セッケン ③ 加水分解 ④ 乳化
⑤ 塩基⑥ アルキルベンゼンスルホン酸 ⑦ 親水
⑧ 脂肪酸⑨ Mg2+ ⑩ 疎水
答え
27 ②28 ⑩29 ⑦30 ⑧ 31 ③32 ⑤33 ⑨34 ⑥ 35 ①
■2010 立命館大学 薬 情報理工 生命科 理工
セッケン分子は,RCOO-がこのような性質をもっているのでミセルを形成する。
しかし,Ca2+やMg2+を多く含む あ や海水では,RCOO-がこれらのイオンと反応して水に溶けにくい塩をつくるので使用できない。
〔1〕 文章中の あ について,最も適当な語句を下の選択肢の中から選び,その番号を解答用紙にマークせよ。
あ:
① 軟水 ② 界面活性剤 ③ コロイド溶液 ④ 乳濁液 ⑤ 王水⑥ 硬水
答え
あ ⑥
■2012 成蹊大学 理工
問 高級脂肪酸のナトリウム塩であるセッケンに関する記述として,誤っているものの組合せを下の①~⑥のうちから一つ選べ。
a セッケンは,水の中に入り込みやすい性質(親水性)のイオンの部分と,水と分離しやすい性質(疎水性)の炭化水素基とからできている。
b セッケンを水に溶かすと,弱酸性を示す。
c 油脂をセッケン水に加えると,油脂はセッケンの親水性部分に囲まれ,細かい粒子となって水の中に分散する。
d セッケンはMg2+やCa2+と反応して水に不溶な塩をつくるため,硬水や海水を用いるとセッケンの洗浄力は低下する。
① a・b② a・c③ a・d④ b・c⑤ b・d⑥ c・d
★☆★④ 溶液の濃度に関する問題★☆★
■2013 九州工業大学 工 情報工
問 海水中に含まれるすべての塩の質量パーセント濃度は3.4%といわれている。密度1.02g/cm3の海水1.0L中に含まれる塩①の質量[g]を有効数字2桁で答えよ。
■2012 芝浦工業大学 工 システム理工 デザイン工
(イ) 海水には様々な物質が溶けていて,海水100g中に溶けている物質の総質量は3.50gである。
そのうち質量パーセントで78.0%が塩化ナトリウムである。海水中に溶解している塩化ナトリウムのモル濃度[mol/L]を有効数字3桁で求めよ。ただし,海水の密度は1.02g/cm3とする。
■2010 中央大学 理工
・海水は質量パーセント濃度3.5%の塩化ナトリウム水溶液とみなすことができる。
27℃でこの塩化ナトリウム水溶液の密度を1.02g/cm3としたとき,そのモル濃度[mol/L]を,有効数字2桁で答えなさい。
★☆★⑤ 浸透圧に関する問題★☆★
■2013 関西学院大学 教育 総合政策 理工
当初, (イ) は,コロイド粒子が通過できない膜を用いて研究・利用されてきた。
例えば,(a)コロイド粒子であるタンパク質の精製では, (ア) を用いた(b)透析という技術が用いられている。
さらに,現在ではナトリウムイオンや塩化物イオンも通過できないような膜も作製され,海水の淡水化に応用されている。
この膜の穴の大きさは,水分子より数倍大きい。水分子の大きさは約0.38nmである。
一方,(c)塩化物イオンとナトリウムイオンの大きさは,大きい方でも直径が0.33nmで水分子よりも小さい。
それにもかかわらず,(d)この穴は水分子のみを選択的に通過させる。例えば,図の装置(略)において,
(e)Aに食塩水を,Bに純水を入れ, (3) 側に (イ) よりも大きな圧力を加えた場合,水分子が (4) 側から (5) 側に向かって (ア) を通過し,
食塩水から純水を得ることができる。
問1.文中の(ア),(イ)に適切な語句を入れよ。
問2.文中の(1)~(5)にA,Bのどちらかを入れよ。
問3.下線部(a)に関して,タンパク質の精製には透析の他に,タンパク質溶液に(あ)直流電圧をかけるとある電極方向にタンパク質が移動する現象や,
(い)多量の電解質を加えるとタンパク質が沈殿する現象が利用される。タンパク質がコロイド粒子であるために示すこれらの現象をそれぞれ何というか書け。
また,(う)タンパク質は疎水コロイドと親水コロイドのどちらであるかを書け。
問4.下線部(b)に関して,透析とはどの様な操作であるか説明せよ。
問5.下線部(c)に関して,塩化物イオンとナトリウムイオンとではどちらが大きいか,電子配置をもとに説明せよ。
問6.下線部(d)に関して,イオンの大きさより大きな穴が空いているにもかかわらず,水のみがこの膜を通過し,イオンは通過できない理由を説明せよ。
答え
問1.(ア) 半透膜(イ) 浸透圧
問2.(1) B(2) A(3) A(4) A(5) B
問3.(あ) 電気泳動(い) 塩析(う) 親水コロイド
問4.得られた溶液を半透膜に包み,純水中につけておくと小さな分子やイオンは半透膜を通って純水中に拡散していくことによりコロイド溶液を精製する操作。
問5.ナトリウムイオンはネオン型の電子配置でK殻とL殻に電子が配置されている。一方,塩化物イオンはアルゴン型の電子配置でM殻にも電子が配置されているため,塩化物イオンの方が大きい。
問6.イオンは水溶液中では,イオンの周囲を水分子が取り巻いた水和イオンとなっており,半透膜の穴よりも大きな粒子となっているため。
■2013 近畿大学 理工 建築 薬 農 生物理工 工 産業理工
(3) 浸透圧に関する次の文A~Dのうちで,正しいものをすべてあげると 36 である。
A 点滴や注射の際に用いられるリンゲル液は,体液と同じ浸透圧をもつ。
B 赤血球を水に入れると赤血球が縮む。
C 半透膜を隔てて海水と水を入れ,海水側に浸透圧以上の圧力を加えると,海水中の水分子が半透膜を通って水側に移動する。
D 浸透圧は,デンプンやタンパク質のような高分子化合物の分子量測定に用いられる。
35 , 36 に対する解答群
① A② B③ C④ D
⑤ AとB⑥ AとC⑦ AとD⑧ BとC
⑨ BとD⑩ CとD⑪ AとBとC ⑫ AとBとD
⑬ AとCとD ⑭ BとCとD
■慶應義塾大学 医
海水の淡水化法のひとつとして,半透膜の両側に海水と真水を置き,海水側に圧力を掛けることによって真水を製造する方法がある。
(1) この方法の名称を答えなさい。
(2) 海水が重量濃度3.00%のNaCl水溶液(密度1.00g/cm3)のみで構成されているとして,淡水化に必要な最低圧力を答えなさい。
ただし,浸透圧(?)はファントホッフの式:?=cRT(ただし,cは水溶液のモル濃度,Rは気体定数,Tは温度)により与えられるものとする。25℃として計算しなさい。
答え
(1) 逆浸透圧法
■2012 日本大学 2/2,A方式(第1期) 生物資源科
5.次の用語の組み合わせのうち,互いの関連が適切でないのは 5 である。
<解答群>
① 再生繊維レーヨン
② 海水淡水化逆浸透
③ ブリキスズ
④ コンクリート鉄による補強
⑤ 炭素繊維高い強度
⑥ 燃焼排ガス硫化水素
⑦ 生活排水BOD
⑧ 炎色反応花火
■2012 弘前大学 教育 理工 農学生命科
問 セロハン膜を利用して海水から純水を調製するにはどのようにすればよいかを説明せよ。
★☆★⑥ イオン交換膜に関する問題★☆★
■2010 早稲田大学 人間科
問 (a)に-N+(CH3)3OH-などの塩基性の官能基を導入した高分子化合物や(b)のようなイオン交換樹脂の用途として,最も適切なものを①~⑧から二つ選びなさい。
① 塗料② 歯科の治療用材料
③ 接着剤④ 海水の淡水化
⑤ 砂漠緑化の保水材⑥ アミノ酸の分離
⑦ 防水材⑧ 生分解性ポリマー
答え
④,⑥
■2012 北里大学 薬
次の文を読み,問 13 ~ 15 に答えよ。 13 ~ 15 につき,それぞれ答を一つずつ選び,解答用紙にマークすること。
図1(略)は,海水から淡水を作ったり,海水から塩化ナトリウムを濃縮したり,海水から有害な重金属イオンを除去する装置である。
陽イオン交換膜と陰イオン交換膜で交互に仕切った電解槽Ⅰ~Ⅴがあり,電解槽Ⅱ,Ⅳには海水を満たし,電解槽Ⅰ,Ⅲ,Ⅴには水を満たした。
この装置では一価のイオンは通過するが二価以上のイオンは通さないタイプのイオン交換膜を使用した。
陽極に炭素電極を,陰極に鉄電極を用いて電気分解を行うと,陰極では水素の発生が,陽極では主に塩素が発生し,酸素の発生も見られた。
13 通電後,電解槽Ⅰ,Ⅲで得られる水溶液の組合せとして,最も適切なものはどれか。
電解槽Ⅰ電解槽Ⅲ
(1)希塩酸塩化マグネシウム水溶液
(2)希塩酸塩化ナトリウム水溶液
(3)水酸化ナトリウム水溶液塩化ナトリウム水溶液
(4)水酸化ナトリウム水溶液塩化マグネシウム水溶液
(5)水酸化マグネシウム水溶液塩化マグネシウム水溶液
(6)水酸化マグネシウム水溶液塩化ナトリウム水溶液
(7)希硫酸塩化ナトリウム水溶液
(8)希硫酸塩化マグネシウム水溶液
14 陽極,陰極いずれの電極も銅に交換した時に見られる現象として,最も適切なものはどれか。
(1) 陽極から塩素が発生し,陰極から水素が発生する。
(2) 陽極の銅がイオンとなって溶解し,陰極から水素が発生する。
(3) 陽極から塩素が発生し,陰極の銅がイオンとなって溶解する。
(4) 陽極から酸素が発生し,陰極から水素が発生する。
(5) 陽極から酸素が発生し,陰極の銅がイオンとなって溶解する。
■2009 宮崎大学 2/25,前期日程 教育文化 工 農
(3) イオン交換樹脂の用途として,適切なものを2つ選んで,その記号を記せ。
(a) 砂漠緑化の保水材(b) 海水の淡水化
(c) 導電性ポリマー(d) 純粋な水の製造
(e) 吸水材(f) 生分解性プラスチック
(g) 乾燥剤
① 物質の種類に関する問題,② 分離・実験装置に関する問題
については
「純物質と混合物 分離に関する問題 完全攻略チャート&過去問解説集」
で詳しく解説しています。
④ 溶液の濃度に関する問題
については
「溶液の濃度に関する問題 完全攻略チャート&過去問解説集」
で詳しく解説しています。
★お知らせ
「くらべてつなげてまとめる化学シリーズ」の問題集+参考書
・くらべてつなげてまとめる無機化学 第一部(pdfデータ 196ページ)
・くらべてつなげてまとめる無機化学 第二部(pdfデータ 133ページ)
・くらべてつなげてまとめる有機化学 第一部(pdfデータ 157ページ)
・くらべてつなげてまとめる有機化学 第二部(pdfデータ 138ページ)
と
「完全攻略チャート&過去問解説集シリーズ」の最新作
・結晶格子に関する問題 完全攻略チャート&過去問解説集
の販売を開始しました。
HP 恋する化学
よりお買い求めいただけます。
宜しくお願い致します。
身の回りの化学(用途・材料) 1族元素編
今日から、センター試験の化学基礎や化学で頻出テーマである身の回りの化学(用途・材料)について解説します。
今日は、1族元素編について。
センター試験は特に時間が勝負なので、あるキーワードに対して
いくつかの関連用語が条件反射的にイメージできるようになることが重要です。
そこで、用途や材料に関するテーマで
入試問題をデータベースソフトで徹底的に調べ上げ、「用途・材料のキーワード」に対する条件反射的に思い浮かべてほしい「物質」をまとめて見ました。
ガラスの原料、洗剤(界面活性剤の働きを高める助剤)……炭酸ナトリウムNa2CO3
ふくらし粉(ベーキングパウダー)、胃腸薬(塩酸を中和するため)、入浴剤、重曹(別名)……炭酸水素ナトリウムNa2HCO3
塩、調味料、化学工業で広く利用
……塩化ナトリウムNaCl
ボタン電池
……リチウムLi
燃料電池
……水素H2
セッケン、紙の原料、化学工業で広く利用
……水酸化ナトリウムNaOH
以下は、用途・材料に関して出題された問題です。
■2013 埼玉大学 理 工
近年,携帯電話やノートパソコンなどの電子機器に,①イオン化傾向が大きいアルカリ金属の ア を活用した二次電池が幅広く利用されている。また,水素と イ の化学反応を利用する燃料電池は,クリーンな発電システムとして注目されている。水素は②水の電気分解によって製造することができ,より効率的な燃料電池を目指して,③水素を吸蔵する金属の研究開発も進められている。燃料電池の電解質には様々な無機化合物が用いられており,その化合物の1つに④リン酸がある。リン酸を電解質に用いた燃料電池では,水素イオンがリン酸水溶液中を移動し, イ と反応して電流を生じる。電流の発生は負極および正極における⑤酸化還元反応に起因する。
(a) 空欄アおよびイにあてはまる適切な物質名を書け。
答え…
ア リチウム
イ 酸素
■2012 熊本大学 理 医 薬 工
周期表の1族に属するリチウム,ナトリウム,カリウムなどの元素を ア ,2族に属するカルシウム,ストロンチウム,バリウムなどの元素を イ という。 ア のイオン半径の大きさは,同じ周期の イ よりも ウ 。また, ア と イ は天然には単体として存在しないため, エ によってつくられる。 ア は空気中の酸素や水と反応しやすいため,その保存は オ の中で行われる。
イ であるカルシウムの確認には,炎色反応が用いられ, カ 色を示す。a)カルシウムの単体は常温で水と反応し,b)得られた水溶液は二酸化炭素と反応して白い沈殿物 キ を生じる。 キ は石灰石や大理石の主成分であり,c)二酸化炭素を含む水に溶ける。
d) キ を900℃以上に加熱することによって生じる酸化カルシウムは,乾燥剤などに用いられている。天然に存在するセッコウは硫酸カルシウム二水和物が主成分であり,e)140℃に加熱すると焼きセッコウになる。
(問1) 文中の ア ~ カ に適切な語句を, キ に適切な化学式をそれぞれ記せ。
(問2) 炭酸ナトリウムは,ガラスなどの原料として多量に用いられている。炭酸ナトリウムの工業的な製造法の名称を記せ。また,この工程では飽和食塩水に2つの物質を添加して炭酸水素ナトリウムを沈殿させ,その後,熱分解して炭酸ナトリウムを得る。飽和食塩水に加えられる2つの物質を化学式で記せ。
答え…
(問1)
ア アルカリ金属 イ アルカリ土類金属 ウ 大きい エ 融解塩電解
オ 石油 カ 橙 キ CaCO3
(問2) アンモニアソーダ法 [ソルベー法],CO2,NH3
■2012 京都女子大学 文 発達教育 家政 現代社会 法
ナトリウムの単体はやわらかく,ナイフで容易に切断することができるが,(a)空気中では直ちに酸化されるため,(b)ナトリウムの単体の保存には注意が必要である。一般にナトリウムのようにイオン化傾向の大きい金属の単体は,水溶液の電気分解では得ることができない。そのため,(c)その酸化物や塩を融解したのち,これを電気分解して単体を得る。
ナトリウムを含む重要な工業原料である炭酸ナトリウムは,ガラスの製造などのために大量に合成されている。下の図は…以下略…。
(1)~(5)略
(6) 化合物D(炭酸水素ナトリウム)は,胃液に含まれる塩酸を中和するために胃腸薬として利用されている。化合物Dと塩酸の反応の反応式を書きなさい。
(7) 化合物C(塩化カルシウム)の用途として次のなかから該当するものをすべて選びなさい。
(a) 乾燥剤(b) 入浴剤(c) ベーキングパウダー
(d) 凍結防止剤(e) 肥料
■ 2013 明治大学一般 農
ナトリウムは,軟らかい銀白色の金属で,水に触れると激しく反応し,ごくわずかな湿気にも反応するので皮膚に触れると激しく侵される。塩素は,刺激臭をもつ黄緑色の気体で,第一次世界大戦の最前線では毒ガス兵器として使用された。ただし,敵とほぼ同数の味方が死んだとされている。ナトリウムと塩素が接触すると激しく反応し,火の玉となって炎を上げ,白煙が立ち昇る。この煙は塩化ナトリウム(NaCl),すなわち食塩であり,われわれの生活には欠かせないものである。ナトリウムも塩素も,自然界には単体では存在しない。
(1) 上記下線部の反応は,あるガスの発生を伴う。そのガスに関する記述として誤っているものは 16 である。
16
A 宇宙で最も存在する量が大きい元素である。
B 最も軽い気体である。
C 捕集するときは下方置換で行う。
D 工業的には水の電気分解や,石油から得られた炭化水素を高温で水と反応させてつくられる。
E 最近では燃料電池にも利用される。
F 亜鉛に希硫酸を加えると発生する。
答え…
C
(2) 以下の物質の中で,乾燥剤として使われないものは 20 である。
20
A NaHCO3 B CaOC シリカゲル D CaCl2 E H2SO4
(3) リン酸は無色の結晶で,潮解性がある。以下の化合物の中で,潮解性を示さないものは 21 である。
21
A NaOHB KOHC MgCl2D FeCl3
E CaCl2F Na2CO3・10H2O
答え
(1) C(2) B(3) D
■東北大学 理
アルカリ金属元素であるナトリウムは,身近に多く存在する元素であり,その塩を日常でもよく利用している。料理の際には,塩化ナトリウムは調味料として,炭酸水素ナトリウムはふくらし粉として利用されている。塩素とナトリウムを含む化合物であるe)次亜塩素酸ナトリウムの水溶液は漂白剤に使用されている。また,f)塩化ナトリウム水溶液の電気分解を利用して得られる水酸化ナトリウムは,広く化学工業で用いられる。
■2013 早稲田大学 一般 基幹理工 創造理工 先進理工
水素を燃料電池に導入すると,空気中の酸素を消費しながら,酸化還元反応に伴うエネルギーを電気エネルギーに変換し,電力として利用することができる。…以下略…
■2012 順天堂大学 一般 医
イオン化傾向が最も大きな金属として,リチウム(Li)が知られている。同じ金属が正極であった時,リチウムを負極に用いると最も大きな起電力が得られる。それを利用したのがリチウム電池であり,現在ボタン電池などとして幅広く用いられている。リチウム電池の代表的なものは金属リチウムと二酸化マンガンをそれぞれ負極,正極とし,電解質としてはリチウム塩を用い,また電解液としてリチウム塩を溶解できる有機溶媒を用いている。リチウム電池に関する次の各問いに答えなさい。…以下略…
■2012 立命館大学 映像 スポーツ健康科 理工 情報理工 生命科 薬
ナトリウムは,イオン化傾向が大きく あ 個の価電子を い して う 価の え になりやすい。また,反応性も大きく(a)常温で水と反応して,水酸化ナトリウムになる。このため,単体のナトリウムは石油中に保存する。
水酸化ナトリウムは,白色の固体で,空気中の水蒸気を吸収し,表面が次第に溶け出し,ついには水溶液になる。また,水酸化ナトリウムは,二酸化炭素と反応してベーキングパウダーや入浴剤の原料となる炭酸水素ナトリウムや,ガラスなどの原料として利用される炭酸ナトリウムを生じる。炭酸水素ナトリウムは,塩の種類としては お 塩で,その水溶液は か である。一方,炭酸ナトリウムは,塩の種類としては き 塩で,その水溶液は く である。(b)炭酸水素ナトリウムは加熱すると容易に分解して二酸化炭素を発生するが,炭酸ナトリウムは熱に安定な化合物である。
炭酸ナトリウムの濃い水溶液を室温で放置して水分を蒸発させると,炭酸ナトリウム十水和物の結晶となる。また,炭酸ナトリウム十水和物の結晶を乾いた空気中に放置すると,徐々に水和水が失われ,その結晶の表面が白色粉末状になる。このように結晶が水和水を失う現象を け という。
〔1〕 文中の あ ~ え にあてはまる数字と語句の組み合わせとして,正しいものを下の①~⑥の中から選び,その番号を解答用紙にマークせよ。
あ い う え
① 1 放出 1 陰イオン
② 1 吸収 1 陰イオン
③ 1 放出 1 陽イオン
④ 2 吸収 2 陽イオン
⑤ 2 放出 2 陽イオン
⑥ 2 吸収 2 陰イオン
〔2〕 下線部(a)の反応で発生する気体の化学式を 内に記入せよ。
〔3〕 文中の お ~ け について,最も適当な語句を下の選択肢の中から選び,その番号を解答用紙にマークせよ。なお,同じ番号を何度用いてもよい。
① 潮解② 電解③ 風解④ 融解⑤ 溶解⑥ 正 ⑦ 酸性⑧ 中性⑨ 塩基性
答え…
〔1〕 ③〔2〕 H2
〔3〕お ⑦か ⑨き ⑥く ⑨け ③
■東京大学 理科一類 理科三類 理科二類
一度放電したら,充電して再び用いるのが困難な電池を一次電池という。リチウムの単体が一次電池の負極として広く用いられるのは,高い電圧を取り出すのに有利なためである。アルカリ金属である①リチウムの単体は水と激しく反応するため,電解質には有機溶媒やポリマーが用いられる。
一方,繰り返し充電と放電が可能な電池を二次電池といい,中でもリチウムイオン二次電池は携帯機器の電源として急速に普及した。リチウムの単体からなる電極は充電と放電の繰り返しには適していないため,負極には②黒鉛を電極の表面に接着したものが用いられる。また,正極には電極表面にコバルト酸リチウムLiCoO2を接着したものが用いられる。
■2013 富山大学 医 薬
塩化ナトリウムは化学工業の原料として重要な化合物であり,塩素,塩酸,水酸化ナトリウム,硫酸ナトリウム,炭酸ナトリウムなどの製造原料として利用される。このうち炭酸ナトリウムはガラス製造の原料や医薬品などとして広く用いられる化合物である。
炭酸ナトリウムは,工業的には次の反応式(1)で表される( あ )法によって製造される。
問1 本文中( あ )に当てはまる炭酸ナトリウムの工業的製法の名称を記せ。
答え…
問1 アンモニアソーダ法 [ソルベー法]
「電離平衡に関する問題 完全攻略チャート&過去問解説集」の販売を開始しました。
完全攻略チャートのサンプルを公開しました。
結晶格子に関する問題のチャート⑤(11枚の中の1枚)
溶液の濃度に関する問題のチャート①(4枚の中の1枚)
気体の製法と性質に関する問題チャート①(5枚の中の1枚)
アセタール化の計算問題のチャート③(7枚の中の1枚)
こちら(HP 恋する化学)よりご購入いただけます。
↓ランキングが見れます。↓
Image may be NSFW.
Clik here to view.
にほんブログ村
Image may be NSFW.
Clik here to view.
にほんブログ村
身の回りの化学(用途・材料) 2族元素編
今日は、身の回りの化学(用途・材料) 2族元素編についてです。
センター試験は特に時間が勝負なので、あるキーワードに対して
いくつかの関連用語が条件反射的にイメージできるようになることが重要です。
そこで、用途や材料に関するテーマで
入試問題をデータベースソフトで徹底的に調べ上げ、「用途・材料のキーワード」に対する条件反射的に思い浮かべてほしい「物質」をまとめました。
2族に属する元素には、ベリリウムBe、マグネシウムMg、カルシウムCa、ストロンチウムSr、バリウムBa、ラジウムRaがあります。
2族元素のうち,Be、MgとCa、Sr、Ba、Raは,多くの点で性質が異なるため、Ca、Sr、Ba、Raをアルカリ土類金属元素とよびBe、Mgと区別しています。
航空機、自動車、スポーツ用具、ノートパソコンなどの軽量な合金の材料……マグネシウムMg
にがりの主成分……塩化マグネシウムMgCl2
※にがりとは、海水からとれる塩化マグネシウムを主成分とする食品添加物。豆乳を豆腐に変える凝固剤として使用されます。
紅色の花火……ストロンチウムSr
凍結防止剤・融雪剤、乾燥剤……塩化カルシウムCaCl2
※凍結防止剤は路面の凍結を防止するために散布する剤のことで、他に塩化マグネシウム、塩化ナトリウムなどがあります。
凍結を防止する主な理由は、塩化カルシウムが水に溶けることで凝固点効果が起こり、融点が低下するためです。
セッコウ、建築材、医療用ギプス……硫酸カルシウムニ水和物CaSO4・2H2O、カルシウムの硫酸塩
白色顔料、X線の造影剤……硫酸バリウムBaSO4
※硫酸バリウムがX線撮影の造影剤に使われるのは、安定で胃液によっても溶解せず、X線をよく遮蔽することから。
「バリウムを飲む」と言われますが、バリウムBaは冷水と反応して、水素を発生するので飲むと危険です。実際に、病院で飲むのはバリウムではなくて硫酸バリウムです!
殺菌剤、漂白剤……さらし粉CaCl(ClO)・H2O
※水酸化カルシウムが塩素を吸収するとさらし粉が生成します。
石灰石・大理石・卵の殻・貝殻・真珠・珊瑚の主成分、チョーク・セメント・ガラスの原料、、グランド用ラインパウダー……炭酸カルシウムCaCO3
※昔はグランド用ラインパウダーには、水酸化カルシウム(消石灰)が使われていましたが、水に溶けると強い塩基性を示し、目に入ると危険だったり触れると手がかぶれるなどの可能性があるため、現在ではあまり使われなくなりました。
酒や駅弁を温めるための発熱剤、乾燥剤……酸化カルシウムCaO
※発熱剤となるのは、水と反応して水酸化カルシウムとなる際に多量の熱を発するため。
漆喰などの建築材料、酸性土壌の改良剤……水酸化カルシウムCa(OH)2
※水酸化カルシウムは消石灰ともよばれ、飽和水溶液は石灰水とよばれます。
漆喰とは、水酸化カルシウムを主成分とする建材。漆喰は水酸化カルシウムが空気中の二酸化炭素を吸収して炭酸カルシウムとなって固まる性質を利用しています。
以下は、用途・材料に関して出題された問題です。
■2009 同志社大学 生命医科 理工 スポーツ健康科 心理 文化情報
2族元素は最外殻に2個の価電子をもつ典型元素である。ベリリウム以外の元素の単体は、水と反応して水酸化物を生じる。
カルシウムの水酸化物は消石灰と呼ばれ、水に少し溶解し、水溶液は強い塩基性を示す。この水酸化カルシウムは土壌中和剤や、さらし粉の製造、建築材料(しっくい)の原料など幅広い用途がある。水酸化カルシウムの飽和水溶液は石灰水と呼ばれ、希硫酸と反応させると、化合物Aが生じる。また、石灰水に二酸化炭素を吹き込むと、化合物Bの白色沈殿が生じる。
さらに二酸化炭素を吹き込むと、化合物Cとなる。この化合物Cは水に溶解する。石灰岩の分布する地帯では、石灰岩の主成分である化合物Bが二酸化炭素を含む雨水と反応し、化合物Cとなって地中に浸透し、さらに地中で二酸化炭素を放出して再び化合物Bとなる。これらの反応が長年にわたって繰り返され、鍾乳洞などの特有の地形が形成される。
バリウムの水酸化物は、水に少し溶解して強い塩基性を示す。この水溶液を希硫酸と反応させると、化合物Dが生じる。また水酸化バリウムを強熱すると酸化バリウムになる。酸化バリウムは塩化ナトリウムと同じ結晶構造をもち、陽イオンと陰イオン間の距離も塩化ナトリウムのそれとほぼ同一である。
問題
下の(a)~(f)の文は、化合物AおよびDについて述べたものである。AとD両方に当てはまる場合は○を、片方に当てはまる場合は該当する記号(AまたはD)を、両方とも当てはまらない場合は×を、それぞれの解答欄に記せ。
(a) 水への溶解度は、硫酸マグネシウムに比べて小さい。
(b) 白色の化合物である。
(c) 医療用に調製されたものは、X線診断の造影剤として用いられる。
(d) にがりの主成分として、とうふの製造に用いられる。
(e) 水和物はセッコウと呼ばれ、医療用ギプスなどに使われる。
(f) 吸湿剤や融雪剤として用いられる。
答え…
(a) ○ (b) ○ (c) D (d) × (e) A (f) ×
■ 2012 熊本大学 理 医 薬 工
周期表の1族に属するリチウム、ナトリウム、カリウムなどの元素を ア 、2族に属するカルシウム、ストロンチウム、バリウムなどの元素を イ という。 ア のイオン半径の大きさは、同じ周期の イ よりも ウ 。また、 ア と イ は天然には単体として存在しないため、 エ によってつくられる。 ア は空気中の酸素や水と反応しやすいため、その保存は オ の中で行われる。
イ であるカルシウムの確認には、炎色反応が用いられ、 カ 色を示す。カルシウムの単体は常温で水と反応し、b)得られた水溶液は二酸化炭素と反応して白い沈殿物 キ を生じる。 キ は石灰石や大理石の主成分であり、c)二酸化炭素を含む水に溶ける。
d) キ を900℃以上に加熱することによって生じる酸化カルシウムは、乾燥剤などに用いられている。天然に存在するセッコウは硫酸カルシウム二水和物が主成分であり、e)140℃に加熱すると焼きセッコウになる。
(問1) 文中の ア ~ カ に適切な語句を、 キ に適切な化学式をそれぞれ記せ。
答え……
(問1)
ア アルカリ金属
イ アルカリ土類金属
ウ 大きい
エ 融解塩電解
オ 石油
カ 橙
キ CaCO3
■ 2013 金沢大学 人間社会 理工 医薬保健
元素Cの水酸化物は水によく溶け、その水溶液に希硫酸を加えると白色の化合物Eが沈殿する。化合物Eは水や酸に不溶で、毒性が低く、 ア の吸収能が高いため、消化管の ア 撮影の造影剤に用いられる。
元素Dは原子番号38の元素である。元素Dは生体内に吸収されると骨に高く集積し、長時間滞留する。元素Dには質量数90の放射性同位体が存在し、原子力事故の際には、放出・拡散が問題となる。一方、元素Dは イ 色の炎色反応を示すが、この炎色反応は花火などに利用されている。
問1 ア ~ エ に入る適切な語句を記入しなさい。
問2 元素C、D、Eの名称を記入しなさい。
答え……
問1
ア X線
イ 紅
問2
C バリウム
D ストロンチウム
E BaSO4
■2012 静岡大学 理 工 農
2族元素はBe、MgとCa、Sr、Ba、Raの二つのグループに分類され、後者は (ア) 金属とよばれる。
2族元素のうち、 (イ) は冷水とは反応しないが(a)熱水と反応する。また、二酸化炭素中でも燃え、二酸化炭素を還元する。 (イ) は軽い金属なので、軽量な合金の材料として利用される。
カルシウムは (イ) よりもイオン化傾向が大きく、常温でも水と反応し化合物Aを生成する。この化合物Aの水溶液に(c)二酸化炭素を吹き込むと、化合物Bの (ウ) 色沈殿を生ずる。さらに、(d)過剰の二酸化炭素を吹き込むと化合物Bの沈殿は溶解する。ストロンチウムは白銀色の金属であり、炎色反応では (オ) 色を発するため、花火などに利用される。
バリウムは空気中では酸化しやすく、水やアルコールとも反応する。水酸化物は、酸化バリウムを水に溶解させることによって生成する。(f)この水酸化バリウム水溶液に希硫酸を加えると、白い沈殿物が生成する。
問1 (ア) ~ (オ) に入る適切な語句を記せ。
問2 下線部(f)の反応により生成した沈殿物が、X線撮影の造影剤に使われるのはなぜか。その理由を35字以内で記せ。
答え……
問1
(ア) アルカリ土類
(イ) マグネシウム [Mg]
(ウ) 白
(エ) 黄リン
(オ) 紅
問2 硫酸バリウムは水や酸に溶けないとともにX線をよく遮蔽するため。
■2010 和歌山大学 教育
石灰石を焼くと (a) が得られる。 (a) は脱水剤や乾燥剤などに用いられる。 (a) にコークスを混ぜて強熱すると、 (b) が得られる。
問 空欄(a)~(b)の化合物名、化学式を書きなさい。
答え……
(a) 酸化カルシウム、CaO
(b) 炭化カルシウム、CaC2
■ 2012 日本大学 生産工
次の 1 、 2 にあてはまる最も適当な答をそれぞれの解答群から一つずつ選びしなさい。
1 は潮解性があるので乾燥剤に利用される。また、 2 の水和物は建築材や医療用ギプスなどに使用されている。
1 と 2 の解答群
① 炭酸水素カルシウム
② 水酸化カルシウム
③ 塩化カルシウム
④ 炭酸カルシウム
⑤ 炭化カルシウム
⑥ 硫酸カルシウム
答え……
1…③ 塩化カルシウム
2…⑥ 硫酸カルシウム
■ 2012 新潟大学 教育 理 医 歯 工 農
カルシウムは2族元素に属している。2族元素にはカルシウムのほかに5種類の元素があるが、 [1] と [2] を除く元素を特に [3] と呼んでいる。(a)2族元素はいずれも2価の陽イオンになりやすい。しかし、(b) [1] と [2] の2つの元素は、単体の反応性において [3] とかなり異なっている。カルシウム金属は1族の金属元素の単体と同様な銀白の光沢を示し、電気や熱をよく通す。
カルシウムの化合物には、炭酸塩、硫酸塩など、水に溶けにくいものが多い。この性質を利用して、カルシウムの硫酸塩はセッコウとして建築材料や医療用ギプスなど広く利用されている。これに対して、塩化物は潮解性を示すなど水によく溶ける。この性質を利用して、塩化カルシウムは乾燥剤などに用いられる。
酸化カルシウムは、天然に大量に存在する炭酸カルシウムを空気中で強熱すると容易に生成する。酸化カルシウムが工業的に利用されている例として、鉄の製錬がある。溶鉱炉では、原料の鉄鉱石中にある不純物の二酸化ケイ素は、炭酸カルシウムの熱分解で生じる酸化カルシウムと反応して、スラグとして銑(せん)鉄から除去されている。また、我々のごく身近なところでは、酸化カルシウムは缶入の酒や弁当を温めるためにも用いられている。
問1 空欄 [1] ~ [3] にあてはまる適切な語あるいは元素記号を書け。
問2 下線部(a)の理由を説明せよ。
答え……
問1
[1]、[2] Be、Mg (順不同)
[3] アルカリ土類金属元素
問2 1原子あたり2つの価電子を持ち、それを取り去ることで安定な電子配置をとるから。
「電離平衡に関する問題 完全攻略チャート&過去問解説集」の販売を開始しました。
完全攻略チャートのサンプルを公開しました。
結晶格子に関する問題のチャート⑤(11枚の中の1枚)
溶液の濃度に関する問題のチャート①(4枚の中の1枚)
気体の製法と性質に関する問題チャート①(5枚の中の1枚)
アセタール化の計算問題のチャート③(7枚の中の1枚)
こちら(HP 恋する化学)よりご購入いただけます。
↓ランキングが見れます。↓
Image may be NSFW.
Clik here to view.
にほんブログ村
Image may be NSFW.
Clik here to view.
にほんブログ村